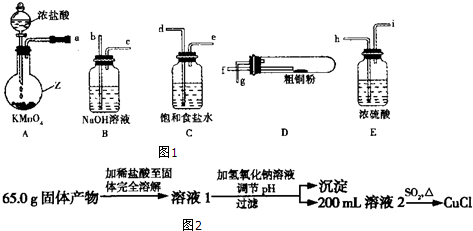
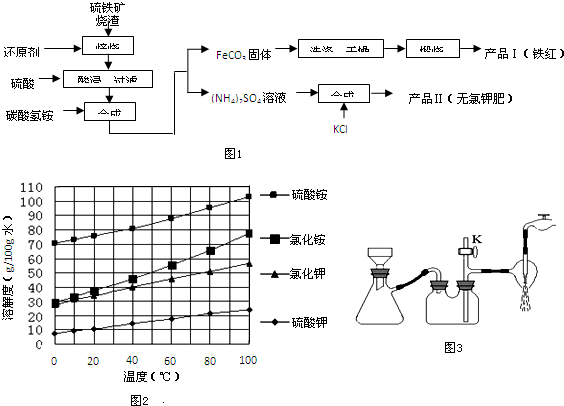
题目内容
12.类推的思维方法可解决不少化学问题,但类推的结论最终要经过实践的检验才能确定其正确与否.下列几种类推结论中,你认为正确的是( )| A. | 沸点HBr>HCl,则同族元素氢化物沸点HCl>HF | |
| B. | Fe3O4可表示为FeO•Fe2O3,则Pb3O4可表示为PbO•Pb2O3 | |
| C. | CO2与Na2O2反应只生成Na2CO3和O2,故SO2与Na2O2反应也只生成Na2SO3和O2 | |
| D. | SiO2能形成原子晶体,一定条件下CO2也能形成原子晶体 |
分析 A.HF分子间存在氢键沸点较高;
B.Pb的化合价为+2价和+4价;
C.过氧化钠具有强的氧化性,能够氧化二氧化硫;
D.在高压下可以将CO2转化为具有类似SiO2结构的原子晶体.
解答 解:A.HF分子间存在氢键沸点较高,所以氢化物沸点:HF>HCl,故A错误;
B.Pb的化合价为+2价和+4价,则Pb3O4可表示为2PbO•PbO2,故B错误;
C.SO2具有还原性,过氧化钠具有强的氧化性,SO2与Na2O2反应生成Na2SO4,故C错误;
D.SiO2能形成原子晶体,在高压下可以将CO2转化为具有类似SiO2结构的原子晶体,所以一定条件下CO2也能形成原子晶体,故D正确.
故选D.
点评 本题考查物质的性质,综合考查元素化合物知识,把握物质的性质及发生的反应、氢键对物理性质的影响等为解答的关键,侧重分析与知识综合应用能力的考查,题目难度不大.

练习册系列答案
 小学生10分钟口算测试100分系列答案
小学生10分钟口算测试100分系列答案
相关题目
8.如图立方烷(C8H8)的球棍模型,下列有关说法不正确的是( )
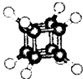

| A. | 它的一氯代物只有一种同分异构体 | |
| B. | 它的二氯代物有三种同分异构体 | |
| C. | 它与苯乙烯(C6H5-CH=CH2)互为同分异构体 | |
| D. | 它是一种不饱和烃,既能发生取代反应,又能发生加成反应 |
3.(1)在1200℃时,天然气脱硫工艺中会发生下列反应:
①H2S(g)+$\frac{3}{2}$O2(g)═SO2(g)+H2O(g)△H1
②2H2S(g)+SO2(g)═$\frac{3}{2}$S2(g)+2H2O(g)△H2
③H2S(g)+$\frac{1}{2}$O2(g)═S(g)+H2O(g)△H3
④2S(g)═S2(g)△H4
则△H4的正确表达式为$\frac{2}{3}$(△H1+△H2-3△H3).
(2)某可逆反应:X(g)+3Y(g)?2Z(g)平衡常数与温度关系如表所示:
①根据上述数据判断,该可逆反应的正反应是放热(填“吸热”或“放热”)反应,理由是温度升高,平衡常数减小.
②为了增大X的转化率和反应速率,宜采用的措施是B.
A.升高温度 B.增大压强 C.加催化剂 D.分离Z
③在2L密闭容器中充入Z气体,在一定条件下进行反应.下列图1象不能表明该反应达到平衡状态的是A.

④440℃时,在2L密闭容器中,开始充入1mol X气体和3mol Y气体进行反应.在某时刻测得c(X)=0.45mol/L,此时,反应是否达到平衡状态否(填“是”或“否”),简述理由:此时浓度商Q=$\frac{{c}^{2}(Z)}{c(X){c}^{3}(Y)}$=$\frac{0.{1}^{2}}{0.45×1.3{5}^{3}}$=0.0090<K,平衡正向进行.
⑤在某容积固定的容器中进行上述反应,当X、Y起始物质的量一定时,仅改变一个外界条件对Z体积分数的影响如图2所示(曲线I为标准):
ⅰ曲线Ⅱ改变的条件是升温.
ⅱ曲线Ⅲ改变的条件是加合适的催化剂.
①H2S(g)+$\frac{3}{2}$O2(g)═SO2(g)+H2O(g)△H1
②2H2S(g)+SO2(g)═$\frac{3}{2}$S2(g)+2H2O(g)△H2
③H2S(g)+$\frac{1}{2}$O2(g)═S(g)+H2O(g)△H3
④2S(g)═S2(g)△H4
则△H4的正确表达式为$\frac{2}{3}$(△H1+△H2-3△H3).
(2)某可逆反应:X(g)+3Y(g)?2Z(g)平衡常数与温度关系如表所示:
| 温度/℃ | 360 | 440 | 520 |
| K | 0.036 | 0.010 | 0.0038 |
②为了增大X的转化率和反应速率,宜采用的措施是B.
A.升高温度 B.增大压强 C.加催化剂 D.分离Z
③在2L密闭容器中充入Z气体,在一定条件下进行反应.下列图1象不能表明该反应达到平衡状态的是A.

④440℃时,在2L密闭容器中,开始充入1mol X气体和3mol Y气体进行反应.在某时刻测得c(X)=0.45mol/L,此时,反应是否达到平衡状态否(填“是”或“否”),简述理由:此时浓度商Q=$\frac{{c}^{2}(Z)}{c(X){c}^{3}(Y)}$=$\frac{0.{1}^{2}}{0.45×1.3{5}^{3}}$=0.0090<K,平衡正向进行.
⑤在某容积固定的容器中进行上述反应,当X、Y起始物质的量一定时,仅改变一个外界条件对Z体积分数的影响如图2所示(曲线I为标准):
ⅰ曲线Ⅱ改变的条件是升温.
ⅱ曲线Ⅲ改变的条件是加合适的催化剂.
20.下列变化中,前者是物理变化,后者是化学变化,且都有明显颜色变化的是( )
| A. | 打开盛装NO的集气瓶;冷却NO2气体 | |
| B. | 用冰水混合物冷却SO3气体;加热氯化铵晶体 | |
| C. | 木炭吸附NO2气体;将氯气通入品红溶液中 | |
| D. | 向酚酞溶液中加入Na2O2;向FeCl3溶液中滴加KSCN溶液 |
4.寻找新能源是解决温室效应的一条重要思路.磷酸亚铁锂LiFePO4是一种新型汽车锂离子电池,总反应为:FePO4+Li $?_{充电}^{放电}$ LiFePO4,电池中的固体电解质可传导离子,下列说法错误的是( )
| A. | 放电时正极材料是磷酸亚铁锂(LiFePO4) | |
| B. | 放电时正极反应为:FePO4+Li++e-═LiFePO4 | |
| C. | 充电时Li+和Fe2+向阴极移动,PO43ˉ向阳极移动 | |
| D. | 充电时阴极反应为:Li++e-═Li |
1.某元素的原子序数为7,下列有关该元素的推断不正确的是( )
| A. | 它处在元素周期表中第二周期ⅤA族 | |
| B. | 它的最高正价为+5,负价为-3 | |
| C. | 它的最高价氧化物对应水化物是一元强酸 | |
| D. | 它的非金属性比磷弱比氧强 |
2.在溶液中能大量共存的一组离子或分子是( )
| A. | c(H+)=0.1 mol•L-1的溶液:Na+、NH4+、SO42-、S2O32- | |
| B. | pH=0的透明溶液中,Na+、Fe3+、MnO4-、NO3- | |
| C. | 稀溴水中:H+、Na+、SO42-、葡萄糖分子 | |
| D. | 0.1mol•L-1的NH4HCO3溶液中:Ca2+、K+、S2-、Br- |