题目内容
7.丙烷(C3H8)和丙烯(C3H6)都可作火炬燃料.(1)丙烷脱氢可得丙烯.
已知:C3H8(g)=CH4(g)+HC≡CH(g)+H2(g)△H1=+156.6kJ•mol-1
CH3CH═CH2(g)=CH4(g)+HC≡CH(g )△H2=+32.4kJ•mol-1
则相同条件下,反应C3H8(g)=CH3CH═CH2(g)+H2(g) 的△H=+124.2 kJ•mol-1.
(2)以丙烷为燃料制作新型燃料电池,电池的正极通入O2和CO2,负极通入丙烷,电解质是熔融碳酸盐.电池负极反应式为C3H8-20e-+10CO32-=13CO2+4H2O;放电时CO32-移向电池的负(填“正”或“负”)极.
(3)碳氢化合物完全燃烧生成CO2和H2O.常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H2CO3)=1.5×10-5 mol•L-1.若忽略水的电离及H2CO3的第二级电离,则H2CO3═HCO3-+H+的平衡常数K1=4.2×10-7 mol•L-1.(已知10-5.60=2.5×10-6)
(4)常温下,0.1mol•L-1NaHCO3溶液的pH大于8,则溶液中:
①c(OH-)=c(H+)+c(H2CO3)-c(CO32-).
②c(H2CO3)>c(CO32-)(填“>”、“=”或“<”),原因是因为NaHCO3溶液中既存在电离平衡:HCO3-?CO32-+H+,又存在水解平衡:HCO3-+H2O?H2CO3+OH-,而HCO3-水解程度大于电离程度(用离子方程式和必要的文字说明).
分析 (1)依据盖斯定律结合已知热化学方程式计算得到;
(2)燃料电池中,负极电极反应式为C3H8-20e-+10CO32-=13CO2+4H2O,正极反应式为:O2+2CO2+4e-=2CO32-,电解质溶液中阴离子向负极移动;
(3)依据平衡常数概念结合平衡状态下离子浓度和同时浓度计算得到;
(4)①根据质子守恒分析解答;②根据NaHCO3溶液的中HCO3-的水解程度大于自身的电离程度来回答.
解答 解:(1)①C3H8(g)→CH4(g)+HC≡CH(g)+H2(g)△H1=156.6kJ•mol-1
②CH3CH=CH2(g)→CH4(g)+HC≡CH(g)△H2=32.4kJ•mol-1
依据盖斯定律①-②得到:C3H8(g)→CH3CH=CH2(g)+H2(g)△H=+124.2KJ/mol,
故答案为:+124.2;
(2)燃料电池中,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应,负极电极反应式为C3H8-20e-+10CO32-=13CO2+4H2O,正极反应式为:O2+2CO2+4e-=2CO32-,放电时,电解质中阴离子碳酸根离子向负极移动,
故答案为:C3H8-20e-+10CO32-=13CO2+4H2O;负;
(3)常温常压下,空气中的CO2溶于水,达到平衡时,溶液的pH=5.60,c(H+)=c(HCO3-)=10-5.6mol/L;c(H2CO3)=1.5×10-5 mol•L-1.若忽略水的电离及H2CO3的第二级电离,则H2CO3的第一级电离的平衡常数K1=$\frac{c({H}^{+})•c(HC{O}_{3}^{-})}{c({H}_{2}C{O}_{3})}$=$\frac{1{0}^{-5.6}×1{0}^{-5.6}}{1.5×1{0}^{-5}}$=4.2×10-7 mol•L-1,故答案为:4.2×10-7 mol•L-1;
(4)①根据质子守恒c(CO32-)+c(OH-)=c(H+)+c(H2CO3),所以c(OH-)=c(H+)+c(H2CO3)-c(CO32-),故答案为:c(H+)+c(H2CO3)-c(CO32-);②因NaHCO3溶液显碱性,HCO3-的水解程度大于自身的电离程度,即NaHCO3溶液中既存在电离平衡为HCO3-?CO32-+H+,水解平衡为HCO3-+H2O?H2CO3+OH-,而HCO3-水解程度大于电离程度,
故答案为:>;因为NaHCO3溶液中既存在电离平衡:HCO3-?CO32-+H+,又存在水解平衡:HCO3-+H2O?H2CO3+OH-,而HCO3-水解程度大于电离程度.
点评 本题考查了燃料电池的工作原理、弱电解质平衡常数的计算、盐类水解的分析,题目难度中等,侧重于考查学生对基础知识的应用能力.

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案| A. | 231.5mL | B. | 268.8mL | C. | 287.5mL | D. | 313.6mL |
| A. | 2mol0.5mol/L硅酸钠溶液中滴入盐酸所制得的硅酸胶体中,含胶粒数目为0.001NA | |
| B. | 8.4gNaHCO3固体中含有的离子总数为0.3NA | |
| C. | 25℃时,1LpH=1的CH3COOH溶液中含有H+数目为0.1NA | |
| D. | 7.8gCaF2固体中含有的共用电子对数目为0.2NA |
| A. | 硅是地壳中含量位居第二的元素,玛瑙、光导纤维的主要成分为SiO2 | |
| B. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| C. | 加碘食盐中加入的是碘单质,可防止甲状腺肿大疾病 | |
| D. | 要除去衣服上的顽固污渍,均可将衣服泡在漂白液中 |
| A. | 0.1mol•L-1的Na3PO4溶液中:c(Na+)=3c(PO43-)+2c(HPO42-)+c(H2PO4-) | |
| B. | 0.1mol•L-1的NaHS溶液中:c(H+)+c(H2S)=c(OH-)+c(S2-) | |
| C. | 0.1mol•L-1的氨水与0.1mol•L-1的NaHSO4溶液等体积混合:c(Na+ )=c(SO42-)=c(NH4+)>C(H+)>C(OH-) | |
| D. | 0.1mol•L-1的Na2CO3溶液与0.1mol•L-1的NaHCO3溶液等体积混合:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) |
| A. | Na+、NH4+、AlO2-、SiO32- | B. | Ca2+、NH4+、NH3﹒H2O、CH3COO- | ||
| C. | Cr2O72-、H+、C2H5OH、NO3- | D. | Cu2+、SO42-、HS-、Cl- |
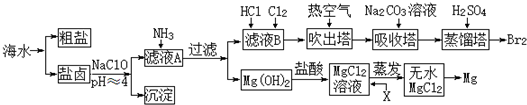

 (R1、R2、R3代表烃基或氢原子)
(R1、R2、R3代表烃基或氢原子) .
. .
. .若一次取样,检验E中所含官能团,按使用顺序加入试剂为Na、银氨溶液(或新制的Cu(OH)2悬浊液).
.若一次取样,检验E中所含官能团,按使用顺序加入试剂为Na、银氨溶液(或新制的Cu(OH)2悬浊液).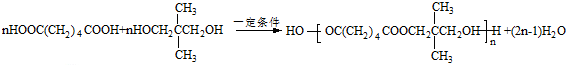 .
.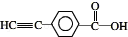
 .
.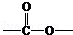 基团
基团