题目内容
20.将O2和NH3的混合气体448mL通过加热的三氧化二铬,充分反应后,再通过足量的水,最终收集到44.8mL气体.原混合气体中O2的体积可能是(假设氨全部被氧化;气体体积均已换算成标准状况)( )| A. | 231.5mL | B. | 268.8mL | C. | 287.5mL | D. | 313.6mL |
分析 发生反应为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O、4NO+3O2+2H2O=4HNO3,剩余的44.8mL气体可能为氧气,有可能是NO,设出混合气体中氨气体积为x、氧气体积为y,然后分别根据剩余气体为氧气、NO结合反应方程式列式计算即可.
解答 解:最终收集到44.8mL气体可能为氧气,有可能为NO,
当剩余气体为氧气时,发生反应有:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O、4NO+3O2+2H2O=4HNO3,设氧气总体积为y,氨气总体积为x,则:①x+y=448mL;由于氨气完全反应,则x体积氨气消耗氧气体积为:x×$\frac{5}{4}$=$\frac{5}{4}$x,同时生成NO体积为x,生成的NO完全反应消耗氧气的体积为:x×$\frac{3}{4}$=$\frac{3}{4}$x,则:②$\frac{5}{4}$x+$\frac{3}{4}$x+44.8mL=y,联立①②解得:x=134.4mL、y=313.6mL,即:氧气体积为313.6mL;
当剩余的气体为NO时,则氧气、氨气完全反应,发生反应为:4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O、4NO+3O2+2H2O=4HNO3,剩余的44.8mL为NO,设原混合气体中氨气体积为x、氧气体积为y,则:③x+y=448mL,氨气完全反应消耗氧气体积为x×$\frac{5}{4}$=$\frac{5}{4}$x,同时生成NO体积为x,其中转化成硝酸的NO体积为:x-44.8mL,此过程中消耗氧气体积为:(x-44.8mL)×$\frac{3}{4}$,消耗氧气总体积为:④$\frac{5}{4}$x+(x-44.8mL)×$\frac{3}{4}$=y,联立③④可得:x=160.5mL、y=287.5mL,即:原混合气体中氧气的总体积为287.5mL,
根据分析可知,原混合气体中氧气总体积可能为:313.6mL或287.5mL,
故选CD.
点评 本题考查了混合物反应的计算,题目难度较大,明确剩余气体组成为解答关键,注意掌握讨论法在化学计算中的应用,试题侧重考查学生的分析、理解能力及化学计算能力.

| A. | 2种 | B. | 3种 | C. | 4种 | D. | 5种 |
| A. | 原子核外电子排布--元素在周期表中的位置 | |
| B. | 弱电解质的相对强弱--电离常数的大小 | |
| C. | 分子间作用力的大小--分子稳定性的高低 | |
| D. | 物质内部储存的能量--化学反应的热效应 |
| A. | 上述过程中,最终被还原的是NO3- | |
| B. | 从上述反应可知氧化性HNO3>Fe3+>稀硫酸 | |
| C. | 上述过程中,会产生一种无色、难溶于水的气体 | |
| D. | 若通入的SO2完全反应,则通入的SO2和逸出的气体物质的量之比为1:1 |
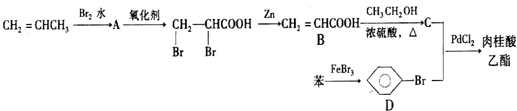
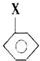 +CH2═CHCOOCH3$\stackrel{PdCl_{2}}{→}$
+CH2═CHCOOCH3$\stackrel{PdCl_{2}}{→}$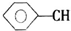 =CHCOOCH3+HX(X为卤素原子)
=CHCOOCH3+HX(X为卤素原子)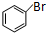 +CH2=CHCOOCH2CH3$\stackrel{PdCl_{2}}{→}$
+CH2=CHCOOCH2CH3$\stackrel{PdCl_{2}}{→}$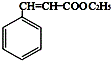 +HBr.
+HBr.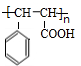 .
. 的物质的量浓度为( )
的物质的量浓度为( )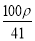 mol·L-1 B.
mol·L-1 B.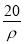 mol·L-1 C.
mol·L-1 C.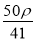 mol·L-1 D.
mol·L-1 D.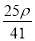 mol·L-1
mol·L-1