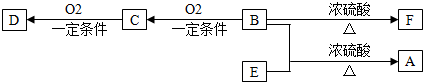
��Ŀ����
17����NAΪ����٤����������ֵ��������˵���в���ȷ���ǣ��������ٳ����£�21g����ϩ��-[CH2-CH2]-���к�����ԭ�ӵ���ĿΪ3NA
����KClO3+6HCl=KCl+3Cl2��+3H2O��Ӧ��ÿ����71g����ת�Ƶĵ�����Ϊ2NA
��3.4gNH3�к�N-H����ĿΪ0.2NA
�ܹ���������ˮ��Ӧ����ת��2NA�����ӣ������������Ϊ32g
����1L0.1mol/L��̼������Һ�У�CO32-����Ϊ0.1NA��
| A�� | �٢ڢۢ� | B�� | �٢ܢ� | C�� | �٢ڢ� | D�� | �ڢۢ� |
���� �پ���ϩ�����ʽΪCH2�����ݾ���ϩ�����ʽ�����21g����ϩ�к��е�Hԭ�ӵ����ʵ�����
�ڷ�ӦKClO3+6HCl��Ũ��=KCl+3Cl2+3H2O�У�KClO3��ClԪ����+5�۱�Ϊ+0�ۣ�HCl��ClԪ����-1�۱�Ϊ0�ۣ��ɷ���ʽ��֪����6molHCl�μӷ�Ӧʱ����5mol��������ת��5mol���ӣ�����3molCl2���Դ˽��м��㣻
�۰��������к���3���������3.4g���������ʵ���Ϊ0.2mol������0.6mol�������
�ܹ���������ˮ��Ӧ�У��������Ƽ���������Ҳ�ǻ�ԭ�����ҹ�����������Ԫ�صĻ��ϼ�Ϊ-1�ۣ�������1mol����ת����2mol���ӣ��ݴ˽��м��㣻
����1L0.1mol/L��̼������Һ�У�CO32-����ˮ�⣬������Һ��̼���������Ŀ���٣�
��� �⣺�پ���ϩ��-[CH2-CH2]-�������ʽΪCH2��21g����ϩ�к������ʽCH2�����ʵ���Ϊ��$\frac{21g}{14g/mol}$=1.5mol������Hԭ�ӵ����ʵ���Ϊ1.5mol��2=3mol��������ԭ�ӵ���ĿΪ3NA���ʢ���ȷ��
�ڷ�Ӧ��KClO3+6HCl=KCl+3Cl2��+3H2O�У�ֻ��ClԪ�ػ��ϼ۷����仯��KClO3Ϊ��������HClΪ��ԭ��������ת�Ƶķ������ĿΪ�� ������3mol Cl2����ʱ��ת��5mol���ӣ�71g���������ʵ���Ϊ��$\frac{71g}{71g/mol}$=1mol��������1mol����ʱת�Ƶĵ���Ϊ��$\frac{5mol}{3mol}$mol=$\frac{5}{3}$mol���ʢڴ���
������3mol Cl2����ʱ��ת��5mol���ӣ�71g���������ʵ���Ϊ��$\frac{71g}{71g/mol}$=1mol��������1mol����ʱת�Ƶĵ���Ϊ��$\frac{5mol}{3mol}$mol=$\frac{5}{3}$mol���ʢڴ���
��3.4g���������ʵ���Ϊ��$\frac{3.4g}{17g/mol}$=0.2mol��0.2mol���������к��е���������ʵ���Ϊ��0.2mol��3=0.6mol����N-H����ĿΪ0.6NA���ʢ۴���
��32g���������ʵ���Ϊ1mol��������������Ԫ�صĻ��ϼ�Ϊ-1�ۣ�������1mol����ת����2mol���ӣ�����ת��2NA�����ӣ��ʢ���ȷ��
����1L0.1mol/L��̼������Һ�У���������̼���Ƶ����ʵ���Ϊ0.1mol������̼������Ӳ���ˮ�⣬����Һ�е�CO32-����С��0.1NA���ʢݴ���
���ݷ�����֪������ȷ��Ϊ�ڢۢݣ�
��ѡD��
���� ���⿼���˰���٤���������ۺ�Ӧ�ã���Ŀ�Ѷ��еȣ��漰������ԭ��Ӧ�ļ��㡢�ε�ˮ��ԭ�����й����ʵ����ļ����֪ʶ������֪ʶ��϶࣬��ֿ���ѧ�����Ӧ�û���֪ʶ����������Ϊ�״��㣬��ȷ�жϻ��ϼ۱仯���Ϊ���ؼ���

 ͨ��ѧ��Ĭд����ϵ�д�
ͨ��ѧ��Ĭд����ϵ�д� ���ƽ̸�������ѡ����ĩ���100��ϵ�д�
���ƽ̸�������ѡ����ĩ���100��ϵ�д�| A�� | 2�� | B�� | 3�� | C�� | 4�� | D�� | 5�� |
| A�� | ���������У����ձ���ԭ����NO3- | |
| B�� | ��������Ӧ��֪������HNO3��Fe3+��ϡ���� | |
| C�� | ���������У������һ����ɫ��������ˮ������ | |
| D�� | ��ͨ���SO2��ȫ��Ӧ����ͨ���SO2���ݳ����������ʵ���֮��Ϊ1��1 |
| A�� | 8�� | B�� | 9�� | C�� | 10�� | D�� | 11�� |
| A�� | ά����C���л�ԭ�ԣ������������������� | |
| B�� | ���ӵ�ʳ�Ρ������������ࡱ��������Ӫ��Ʒ�������߸�ţ�̡������������͡��ȵȣ�����ĵ⡢������ָ���ǻ�����ơ�����ֱ���Ca2+��Fe3+ | |
| C�� | �������������Ա��������Χ��ʯ�ң����л�����������ֹ�ֺ�������� | |
| D�� | Ϊ��ֹ�����±��ȸ�֬ʳƷ�������ʣ����ڰ�װ���з������������Ȼ�ԭ������ |
 ������������ͨ����ɫ��ѧ;����ȡ�����ǵ�ǰ��Դ��չ��һ����Ҫ������ͼ��ʾ������CaOΪ�����壬�������ʾ���ˮ������Ӧ��ȡH2�����̣������ʼ�дΪC����
������������ͨ����ɫ��ѧ;����ȡ�����ǵ�ǰ��Դ��չ��һ����Ҫ������ͼ��ʾ������CaOΪ�����壬�������ʾ���ˮ������Ӧ��ȡH2�����̣������ʼ�дΪC������������¯��ȼ��¯�зֱ�������Ҫ��Ӧ�����ʾ��
| ����¯ | ȼ��¯ |
| ��C��s��+H2O��g��?CO��g��+H2��g����H=+131.6kJ•mol-1 ��CO��g��+H2O��g��?CO2��g��+H2��g����H=-41.2kJ•mol-1 ��CaO��s��+CO2��g��?CaCO3��s����H=-178.3kJ•mol-1 | ��C��s��+O2��g���TCO2��g�� ��H=-393.8kJ•mol-1 ��CaCO3��s��?CaO��s��+CO2��g�� K |
��1������¯�е��ܷ�ӦΪC��s��+2H2O��g��+CaO��s���TCaCO3��s��+2H2��g����H=-87.9 kJ•mol-1��
��2��ȼ��¯�з�Ӧ������������ɷ�Ӧ���ṩ���������1mol CaO��������ͨ�봿��0.453mol��������λС���㣩
��3���±��г����ǵ�ֻ�ı��¶Ȼ�ѹǿʱ����Ӧ����CO2��Ũ�Ⱥ�CaCO3�IJ����ʵı仯��
 | 0 | 5 | 10 | 15 | 20 | 25 |
| T1 | 0 | 1.5 | 2.3 | 4.0 | 4.0 | 4.0 |
| T2 | 0 | 1.0 | 1.8 | 2.8 | 3.1 | 3.1 |
 | 0 | 5 | 10 | 15 | 20 | 25 |
| p1 | 1 | 0.90 | 0.83 | 0.75 | 0.75 | 0.75 |
| p2 | 1 | 0.58 | 0.35 | 0.31 | 0.30 | 0.30 |
��������̼���Σ�Li2CO3��Ϊ����ʣ�һ����̼-����ȼ�ϵ�صĸ�����ӦʽΪCO-2e-+CO32-=2CO2���ڱ�״���£�11.2L�������뷴Ӧ��������ת�Ƶĵ�����Ϊ2NA����1.204��1024����
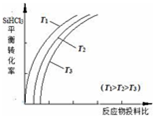 ����Ԫ�صĻ�����㷺��������Ȼ���У����������ﹲͬ������ʯ������裨�۵� 1410�棩��;�㷺����ȡ���ᴿ�����ж��֣�
����Ԫ�صĻ�����㷺��������Ȼ���У����������ﹲͬ������ʯ������裨�۵� 1410�棩��;�㷺����ȡ���ᴿ�����ж��֣�