题目内容
20.用NA表示阿伏加德罗常数的值,下列说法正确的是( )| A. | 2mol0.5mol/L硅酸钠溶液中滴入盐酸所制得的硅酸胶体中,含胶粒数目为0.001NA | |
| B. | 8.4gNaHCO3固体中含有的离子总数为0.3NA | |
| C. | 25℃时,1LpH=1的CH3COOH溶液中含有H+数目为0.1NA | |
| D. | 7.8gCaF2固体中含有的共用电子对数目为0.2NA |
分析 A.胶粒是一定数目粒子的集合体;
B.求出NaHCO3的物质的量,然后根据1molNaHCO3晶体中含1mol钠离子和1molHCO3-来计算;
C.根据溶液中的C(H+)=0.1mol/L来计算;
D.氟化钙为离子化合物,其化学式中不存在共用电子对.
解答 解:A.胶粒是一定数目粒子的集合体,将2 mL 0.5 mol/L硅酸钠溶液滴入盐酸中制得硅酸胶体,所含胶粒数目小于0.001NA,故A错误;
B.8.4gNaHCO3的物质的量为n=$\frac{8.4g}{84g/mol}$=0.1mol,而1molNaHCO3晶体中含1mol钠离子和1molHCO3-,0.1molNaHCO3晶体中含0.1mol钠离子和0.1molHCO3-,即0.2mol离子,故B错误;
C.25℃时,pH=1的溶液中的c(H+)=0.1mol/L,故溶液中的氢离子的物质的量为:n=cV=0.1mol/L×1L=0.1mol,含有氢离子个数为0.1NA,故C正确;
D.CaF2为离子化合物,氟化钙中不存在共用电子对,故D错误;
故选C.
点评 本题考查了阿伏伽德罗常数的应用,题目难度中等,注意掌握物质的量与阿伏伽德罗常数、摩尔质量、物质的量浓度等物理量之间的转化,明确胶体粒子为聚集体,为易错点.

练习册系列答案
相关题目
8.SO2通入足量的Fe(NO3)3稀溶液中,溶液由棕色变为浅绿色,但立即又变成棕黄色,这时若滴入BaCl2溶液,会产生白色沉淀.针对上述一系列变化,下列说法错误的是( )
| A. | 上述过程中,最终被还原的是NO3- | |
| B. | 从上述反应可知氧化性HNO3>Fe3+>稀硫酸 | |
| C. | 上述过程中,会产生一种无色、难溶于水的气体 | |
| D. | 若通入的SO2完全反应,则通入的SO2和逸出的气体物质的量之比为1:1 |
15.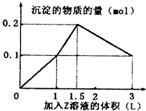 某混合溶液中,含溶质X、Y各0.1mol,向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如图,则符合条件的X、Y、Z分别是( )
某混合溶液中,含溶质X、Y各0.1mol,向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如图,则符合条件的X、Y、Z分别是( )
 某混合溶液中,含溶质X、Y各0.1mol,向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如图,则符合条件的X、Y、Z分别是( )
某混合溶液中,含溶质X、Y各0.1mol,向其中滴加0.1mol/L的Z溶液,所得沉淀的物质的量如图,则符合条件的X、Y、Z分别是( )| A. | 偏铝酸钠、氢氧化钡、硫酸 | B. | 偏铝酸钠、氯化钡、硫酸 | ||
| C. | 氯化铝、氯化镁、氢氧化钠 | D. | 氯化铝、氯化铁、氢氧化钠 |
12.分子式为C6H14O的醇有多种结构,其中能经过两步氧化生成羧酸的结构有(不考虑立体异构)( )
| A. | 8种 | B. | 9种 | C. | 10种 | D. | 11种 |
7.下列反应中,水既不是氧化剂又不是还原剂,但属于氧化还原反应的是( )
| A. | H2O+2F2═4HF+O2 | B. | H2O+3NO2═2HNO3+NO | ||
| C. | 3H2O+P2O5═2H3PO4 | D. | H2O+Si+2NaOH═2H2↑+Na2SiO3 |
 的物质的量浓度为( )
的物质的量浓度为( )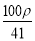 mol·L-1 B.
mol·L-1 B.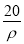 mol·L-1 C.
mol·L-1 C.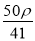 mol·L-1 D.
mol·L-1 D.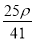 mol·L-1
mol·L-1 含硅元素的化合物广泛存在于自然界中,与其他矿物共同构成岩石.晶体硅(熔点 1410℃)用途广泛,制取与提纯方法有多种.
含硅元素的化合物广泛存在于自然界中,与其他矿物共同构成岩石.晶体硅(熔点 1410℃)用途广泛,制取与提纯方法有多种.