题目内容
16.下列微粒可以大量共存于同一溶液中的是( )| A. | Na+、NH4+、AlO2-、SiO32- | B. | Ca2+、NH4+、NH3﹒H2O、CH3COO- | ||
| C. | Cr2O72-、H+、C2H5OH、NO3- | D. | Cu2+、SO42-、HS-、Cl- |
分析 A.铵根离子与偏铝酸根离子、硅酸根离子发生双水解反应;
B.四种粒子之间不反应,能够大量共存;
C.重铬酸根离子在酸性条件下具有强氧化性,能够氧化乙醇;
D.铁离子与硫氢根离子发生双水解反应.
解答 解:A.NH4+与AlO2-、SiO32-发生双水解反应,在溶液中不能大量共存,故A错误;
B.Ca2+、NH4+、NH3﹒H2O、CH3COO-之间不发生反应,在溶液中可以大量共存,故B正确;
C.Cr2O72-、H+、C2H5OH之间发生氧化还原反应,在溶液中不能大量共存,故C错误;
D.Cu2+、HS-之间发生双水解反应,在溶液中不能大量共存,故D错误;
故选B.
点评 本题考查离子共存的判断,题目难度中等,明确离子反应发生条件为解答关键,注意掌握常见的离子之间不能共存的情况,如:能发生复分解反应的离子之间,能发生氧化还原反应的离子之间,能发生络合反应的离子之间(如 Fe3+和 SCN-)等,试题培养了学生灵活应用基础知识的能力.

练习册系列答案
相关题目
7.下列反应中,水既不是氧化剂又不是还原剂,但属于氧化还原反应的是( )
| A. | H2O+2F2═4HF+O2 | B. | H2O+3NO2═2HNO3+NO | ||
| C. | 3H2O+P2O5═2H3PO4 | D. | H2O+Si+2NaOH═2H2↑+Na2SiO3 |
4. Ⅰ、由生物质能通过绿色化学途径制取氢气是当前能源发展的一个重要方向.如图表示的是以CaO为吸收体,将生物质经与水蒸气反应制取H2的流程(生物质简写为C).
Ⅰ、由生物质能通过绿色化学途径制取氢气是当前能源发展的一个重要方向.如图表示的是以CaO为吸收体,将生物质经与水蒸气反应制取H2的流程(生物质简写为C).
其中气化炉和燃烧炉中分别发生的主要反应如表所示:
请回答下列问题:
(1)气化炉中的总反应为C(s)+2H2O(g)+CaO(s)═CaCO3(s)+2H2(g)△H=-87.9 kJ•mol-1.
(2)燃烧炉中反应⑤所需的能量由反应④提供.如果生成1mol CaO,至少需通入纯氧0.453mol.(留三位小数点)
(3)下表列出的是当只改变温度或压强时,反应⑤中CO2的浓度和CaCO3的残留率的变化.
由表中数据可知,随着温度升高,反应⑤K值增大(填“增大”、“减小”或“不变”),T1>T2(填“>”或“<”,下同);随着压强增大,CaCO3的分解率减小,则p1>p2.
Ⅱ、以熔融碳酸盐(Li2CO3)为电解质,一氧化碳-空气燃料电池的负极反应式为CO-2e-+CO32-=2CO2.在标准状况下,11.2L氧气参与反应,理论上转移的电子数为2NA(或1.204×1024).
 Ⅰ、由生物质能通过绿色化学途径制取氢气是当前能源发展的一个重要方向.如图表示的是以CaO为吸收体,将生物质经与水蒸气反应制取H2的流程(生物质简写为C).
Ⅰ、由生物质能通过绿色化学途径制取氢气是当前能源发展的一个重要方向.如图表示的是以CaO为吸收体,将生物质经与水蒸气反应制取H2的流程(生物质简写为C).其中气化炉和燃烧炉中分别发生的主要反应如表所示:
| 气化炉 | 燃烧炉 |
| ①C(s)+H2O(g)?CO(g)+H2(g)△H=+131.6kJ•mol-1 ②CO(g)+H2O(g)?CO2(g)+H2(g)△H=-41.2kJ•mol-1 ③CaO(s)+CO2(g)?CaCO3(s)△H=-178.3kJ•mol-1 | ④C(s)+O2(g)═CO2(g) △H=-393.8kJ•mol-1 ⑤CaCO3(s)?CaO(s)+CO2(g) K |
(1)气化炉中的总反应为C(s)+2H2O(g)+CaO(s)═CaCO3(s)+2H2(g)△H=-87.9 kJ•mol-1.
(2)燃烧炉中反应⑤所需的能量由反应④提供.如果生成1mol CaO,至少需通入纯氧0.453mol.(留三位小数点)
(3)下表列出的是当只改变温度或压强时,反应⑤中CO2的浓度和CaCO3的残留率的变化.
 | 0 | 5 | 10 | 15 | 20 | 25 |
| T1 | 0 | 1.5 | 2.3 | 4.0 | 4.0 | 4.0 |
| T2 | 0 | 1.0 | 1.8 | 2.8 | 3.1 | 3.1 |
 | 0 | 5 | 10 | 15 | 20 | 25 |
| p1 | 1 | 0.90 | 0.83 | 0.75 | 0.75 | 0.75 |
| p2 | 1 | 0.58 | 0.35 | 0.31 | 0.30 | 0.30 |
Ⅱ、以熔融碳酸盐(Li2CO3)为电解质,一氧化碳-空气燃料电池的负极反应式为CO-2e-+CO32-=2CO2.在标准状况下,11.2L氧气参与反应,理论上转移的电子数为2NA(或1.204×1024).
8.设NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 高温、高压、催化剂条件下,1 mol N2与足量H2充分反应转移的电子数为6 NA | |
| B. | 将NO2和NO混合,标准状况下,22.4 L混合气体中所含的氮原子总数为2 NA | |
| C. | 常温下,10 L pH=12的Na2CO3溶液中含有的OH-离子数为0.1NA | |
| D. | 将含有1molFeCl3的浓溶液完全水解可得到Fe(OH)3胶粒的数目为NA |
3. 在t℃时,AgCl在水中的沉淀溶解平衡曲线如图所示(假设AgCl饱和溶液的密度与水的密度近似相等).下列说法错误的是( )
在t℃时,AgCl在水中的沉淀溶解平衡曲线如图所示(假设AgCl饱和溶液的密度与水的密度近似相等).下列说法错误的是( )
 在t℃时,AgCl在水中的沉淀溶解平衡曲线如图所示(假设AgCl饱和溶液的密度与水的密度近似相等).下列说法错误的是( )
在t℃时,AgCl在水中的沉淀溶解平衡曲线如图所示(假设AgCl饱和溶液的密度与水的密度近似相等).下列说法错误的是( )| A. | 在t℃时,AgCl的Ksp为4×10-10 | |
| B. | 在t℃时,c点溶液中一定有AgCl沉淀析出 | |
| C. | 在t℃时,AgCl的溶解度约为2.9×10-4g | |
| D. | d点溶液,温度升高后c(Ag+),c(Cl-)均会减小 |
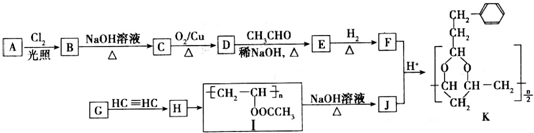
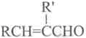 +H2O(R,R′表示烃基或氢)
+H2O(R,R′表示烃基或氢)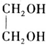 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$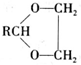 +H2O
+H2O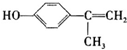 (写结构简式).
(写结构简式).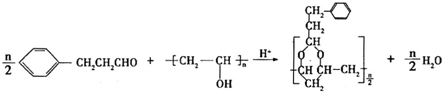 .
.