题目内容
12.25℃时,下列有关溶液中微粒的物质的量浓度关系正确的是( )| A. | 0.1mol•L-1的Na3PO4溶液中:c(Na+)=3c(PO43-)+2c(HPO42-)+c(H2PO4-) | |
| B. | 0.1mol•L-1的NaHS溶液中:c(H+)+c(H2S)=c(OH-)+c(S2-) | |
| C. | 0.1mol•L-1的氨水与0.1mol•L-1的NaHSO4溶液等体积混合:c(Na+ )=c(SO42-)=c(NH4+)>C(H+)>C(OH-) | |
| D. | 0.1mol•L-1的Na2CO3溶液与0.1mol•L-1的NaHCO3溶液等体积混合:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-) |
分析 A.根据磷酸钠溶液中的物料守恒判断;
B.根据硫氢化钠溶液中的质子守恒判断;
C.二者反应后生成等浓度的硫酸钠、硫酸铵,铵根离子部分水解,则c(Na+ )=c(SO42-)>c(NH4+);
D.碳酸根离子的水解程度大于碳酸氢根离子,则c(HCO3-)>c(CO32-).
解答 解:A.0.1mol•L-1的Na3PO4溶液中,根据物料守恒可得:c(Na+)=3c(PO43-)+3c(HPO42-)+3c(H2PO4-),故A错误;
B.0.1mol•L-1的NaHS溶液中,根据质子守恒可得:c(H+)+c(H2S)=c(OH-)+c(S2-),故B正确;
C.0.1mol•L-1的氨水与0.1mol•L-1的NaHSO4溶液等体积混合,二者恰好反应生成等浓度的硫酸钠、硫酸铵,铵根离子部分水解,溶液显示酸性,则溶液中正确的离子浓度大小为:c(Na+ )=c(SO42-)>c(NH4+)>c(H+)>c(OH-),故C错误;
D.0.1mol•L-1的Na2CO3溶液与0.1mol•L-1的NaHCO3溶液等体积混合,由于碳酸根离子的水解程度大于碳酸氢根离子,则c(HCO3-)>c(CO32-),溶液中正确的离子浓度大小为:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-),故D错误;
故选B.
点评 本题考查了离子浓度大小比较,题目难度中等,明确混合液中溶质组成及盐的水解原理为解答关键,注意掌握根据电荷守恒、物料守恒及质子守恒判断溶液中离子浓度大小的方法.

练习册系列答案
 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案
相关题目
20.生活中的一些问题常涉及到化学知识,下列叙述不正确的是( )
| A. | 维生素C具有还原性,在人体内起抗氧化作用 | |
| B. | “加碘食盐”、“含氟牙膏”、“富硒营养品”、“高钙牛奶”、“加铁酱油”等等,这里的碘、氟、硒指的是化合物,钙、铁则分别是Ca2+和Fe3+ | |
| C. | 发生地震后,防疫人员在震区周围撒石灰,进行环境消毒,防止灾后出现疫情 | |
| D. | 为防止中秋月饼等富脂食品氧化变质,常在包装袋中放入硫酸亚铁等还原性物质 |
17.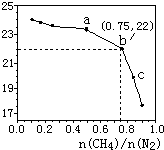 已知:在700℃的恒温、恒容密闭容器中发生反应3CH4(g)+2N2(g)?3C(s)+4NH3(g),若CH4与N2在不同投料比$\frac{n(C{H}_{4})}{n({N}_{2})}$时CH4的平衡转化率如图所示,下列说法正确的是( )
已知:在700℃的恒温、恒容密闭容器中发生反应3CH4(g)+2N2(g)?3C(s)+4NH3(g),若CH4与N2在不同投料比$\frac{n(C{H}_{4})}{n({N}_{2})}$时CH4的平衡转化率如图所示,下列说法正确的是( )
 已知:在700℃的恒温、恒容密闭容器中发生反应3CH4(g)+2N2(g)?3C(s)+4NH3(g),若CH4与N2在不同投料比$\frac{n(C{H}_{4})}{n({N}_{2})}$时CH4的平衡转化率如图所示,下列说法正确的是( )
已知:在700℃的恒温、恒容密闭容器中发生反应3CH4(g)+2N2(g)?3C(s)+4NH3(g),若CH4与N2在不同投料比$\frac{n(C{H}_{4})}{n({N}_{2})}$时CH4的平衡转化率如图所示,下列说法正确的是( )| A. | n(CH4)/n(N2)越大,CH4的转化率越高 | |
| B. | a点对应的平衡常数比c点的大 | |
| C. | b点对应的NH3的体积分数为26% | |
| D. | 不改变投料比,增加n(N2)时,NH3体积分数增大 |
20.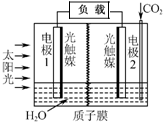 利用人工模拟光合作用合成甲酸的原理为:
利用人工模拟光合作用合成甲酸的原理为:
太阳能光触媒2CO2+2H2O $→_{光触媒}^{太阳能}$ 2HCOOH+O2,装置如图所示,下列说法不正确的是( )
 利用人工模拟光合作用合成甲酸的原理为:
利用人工模拟光合作用合成甲酸的原理为:太阳能光触媒2CO2+2H2O $→_{光触媒}^{太阳能}$ 2HCOOH+O2,装置如图所示,下列说法不正确的是( )
| A. | 电极1周围pH增大 | |
| B. | 电子由电极1经过负载流向电极2 | |
| C. | 电极2的反应式:CO2+2H++2e-=HCOOH | |
| D. | 该装置能将太阳能转化为化学能和电能 |
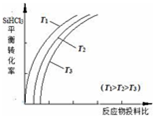 含硅元素的化合物广泛存在于自然界中,与其他矿物共同构成岩石.晶体硅(熔点 1410℃)用途广泛,制取与提纯方法有多种.
含硅元素的化合物广泛存在于自然界中,与其他矿物共同构成岩石.晶体硅(熔点 1410℃)用途广泛,制取与提纯方法有多种.
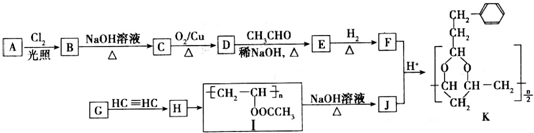
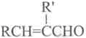 +H2O(R,R′表示烃基或氢)
+H2O(R,R′表示烃基或氢)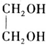 $\stackrel{H+}{→}$
$\stackrel{H+}{→}$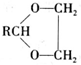 +H2O
+H2O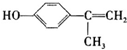 (写结构简式).
(写结构简式).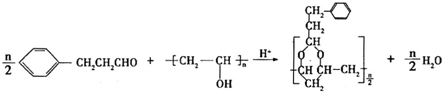 .
.