题目内容
12.下列说法正确的是( )
| A. | 由图甲可知,升高温度醋酸钠的水解程度增大 | |
| B. | 由图乙可知,a点Kw的数值比b点Kw的数值大 | |
| C. | 由图丙可知,反应A(g)+B(g)=2C(g)是吸热反应 | |
| D. | 由图丁可知,反应C(金刚石,s)=C(石墨,s)的焓变△H=△H1-△H2 |
分析 A、图中分析可知随温度升高溶液PH增大,说明升温促进醋酸根离子水解;
B、离子积常数只随温度变化;
C、依据图象分析,先拐先平,温度高,T1<T2,结合化学平衡移动原理分析C体积分数随温度变化判断反应能量变化;
D、由图得:①C(S,石墨)+O2(g)=CO2(g)△H1,
②C(S,金刚石)+O2(g)=CO2(g)△H2,利用盖斯定律将②-①可得:C(S,金刚石)=C(S,石墨)△H2-△H1.
解答 解:A、图中分析可知随温度升高溶液PH增大,醋酸根离子水解显碱性,说明升温促进醋酸根离子水解,升高温度醋酸钠的水解程度增大,故A正确;
B、离子积常数只随温度变化,ab点的温度都是25°C,a点Kw的数值和b点Kw的数值相同,故B错误;
C、依据图象分析,先拐先平,温度高,T1<T2,结合化学平衡移动原理分析C体积分数随温度变化,温度越高C体积分数越小,说明升温平衡逆向进行,正反应为放热反应,故C错误;
D、由图得:①C(S,石墨)+O2(g)=CO2(g)△H1,②C(S,金刚石)+O2(g)=CO2(g)△H2,利用盖斯定律将②-①可得:C(S,金刚石)=C(S,石墨)焓变△H=△H2-△H1,故D错误;
故选A.
点评 本题考查了盐类水解、化学平衡影响因素分析,热化学方程式书写方法,注意盖斯定律的计算应用,温度不变,溶液的离子积不变,掌握基础是关键,题目难度中等.

练习册系列答案
相关题目
2.从化学角度分析,下列叙述不正确的是( )
| A. | 银氨溶液或新制Cu(OH)2均能检验糖尿病人尿液中的葡萄糖 | |
| B. | 在燃煤中加入适量生石灰,可以减少二氧化硫的排放 | |
| C. | 铜制品在潮湿环境中的腐蚀比干燥环境中快 | |
| D. | 生活中的水杯、奶瓶、食物保鲜膜等可以使用聚氯乙烯来制造 |
3. 碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液.生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g )+CH3OCOOCH3(g)?2CH3OCOOC2H5(g).其它条件相同时,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比(R=n(C2H3OCOOC2H5):n(CH3OCOOCH3)的关系如图所示.三种反应物配比分别为1:1、2:1、3:1.下列说法不正确的是( )
碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液.生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g )+CH3OCOOCH3(g)?2CH3OCOOC2H5(g).其它条件相同时,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比(R=n(C2H3OCOOC2H5):n(CH3OCOOCH3)的关系如图所示.三种反应物配比分别为1:1、2:1、3:1.下列说法不正确的是( )
 碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液.生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g )+CH3OCOOCH3(g)?2CH3OCOOC2H5(g).其它条件相同时,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比(R=n(C2H3OCOOC2H5):n(CH3OCOOCH3)的关系如图所示.三种反应物配比分别为1:1、2:1、3:1.下列说法不正确的是( )
碳酸甲乙酯(CH3OCOOC2H5)是一种理想的锂电池有机电解液.生成碳酸甲乙酯的原理为:C2H5OCOOC2H5(g )+CH3OCOOCH3(g)?2CH3OCOOC2H5(g).其它条件相同时,CH3OCOOCH3的平衡转化率(α)与温度(T)、反应物配比(R=n(C2H3OCOOC2H5):n(CH3OCOOCH3)的关系如图所示.三种反应物配比分别为1:1、2:1、3:1.下列说法不正确的是( )| A. | 该反应的逆反应△H>0 | |
| B. | 增大反应物中CH3OCOOCH3的浓度能提高碳酸甲乙酯的平衡转化率 | |
| C. | 650℃,反应物配比为1:1时,平衡常数K=6 | |
| D. | 当C2H5OCOOC2H5与CH3OCOOC2H5生成速率比为1:2时,反应达到平衡状态 |
17.氨氮废水中的氮元素多以NH4+和NH3•H2O的形式存在,在一定条件下,NH4+经过两步反应被氧化成NO3-,两步反应的能量变化示意图如图所示:
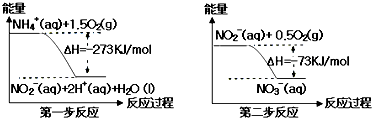
下列说法合理的是( )

下列说法合理的是( )
| A. | 该反应的催化剂是NO2- | |
| B. | 升高温度,两步反应速率均加快,有利于NH4+ 转化成NO3- | |
| C. | 在第一步反应中,当溶液中水的电离程度不变时,该反应即达平衡状态 | |
| D. | 1 mol NH4+在第一步反应中与1 mol NO2-在第二步反应中失电子数之比为1:3 |
1.某学生以铁丝和Cl2为原料进行下列三个实验.从分类角度下列分析正确的是( )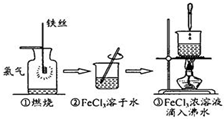

| A. | 实验①、③反应制得的物质均为纯净物 | |
| B. | 实验②、③均未发生氧化还原反应 | |
| C. | 实验②、③均为放热反应 | |
| D. | 实验①、②所涉及的物质均为电解质或非电解质 |
2.下列说法正确的是( )
| A. | 向漂白粉中滴入60%的硫酸,产生黄绿色气体,说明硫酸具有还原性 | |
| B. | 实验室中将海带中的I-完全氧化为I2时,宜选用H2O2作氧化剂而不用HNO3 | |
| C. | 由于Ksp(BaSO4)<Ksp(BaCO3),因此BaSO4沉淀不可能转化为BaCO3沉淀 | |
| D. | 25℃时,100mLpH=13的Ba(OH)2溶液中OH-的物质的量为0.02 mol |
 A、B、C、D、E是原子序数依次递增的短周期元素,A+无电子,BD与C2是等电子体,第一电离能:C>D>B,D和E同主族,ED2是形成酸雨的主要危害气体,F元素位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.
A、B、C、D、E是原子序数依次递增的短周期元素,A+无电子,BD与C2是等电子体,第一电离能:C>D>B,D和E同主族,ED2是形成酸雨的主要危害气体,F元素位于第四周期,其基态原子的内层轨道全部排满电子,且最外层电子数为2.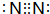 ,E属于元素周期表中ds区
,E属于元素周期表中ds区