题目内容
2.下列说法正确的是( )| A. | 向漂白粉中滴入60%的硫酸,产生黄绿色气体,说明硫酸具有还原性 | |
| B. | 实验室中将海带中的I-完全氧化为I2时,宜选用H2O2作氧化剂而不用HNO3 | |
| C. | 由于Ksp(BaSO4)<Ksp(BaCO3),因此BaSO4沉淀不可能转化为BaCO3沉淀 | |
| D. | 25℃时,100mLpH=13的Ba(OH)2溶液中OH-的物质的量为0.02 mol |
分析 A、漂白粉中加入硫酸,生成黄绿色气体是氯气;
B、硝酸作氧化剂能够生成有毒气体;
C、Qc>Ksp时,沉淀可以发生转化;
D、pH=13的Ba(OH)2溶液中c(OH-)的浓度为0.1mol/L.
解答 解:A、漂白粉在酸性环境中,氯离子和次氯酸根离子反应生成氯气,不是因为硫酸的还原性导致,故A错误;
B、硝酸氧化碘离子时,能够生成氮的氧化物,有毒,故B错误;
C、向BaSO4的饱和溶液中加入大量碳酸根离子,当Qc(BaCO3)>Ksp(BaCO3)时,BaSO4沉淀能转化为BaCO3沉淀,故C错误;
D、25℃时,100mLpH=13的Ba(OH)2溶液中OH-的物质的量为0.01mol,根D错误;
故选B.
点评 本题考查了氧化还原反应、沉淀转化、pH与离子浓度计算,题目难度不大,注意硝酸作氧化剂时产生有毒气体.

练习册系列答案
相关题目
12.下列说法正确的是( )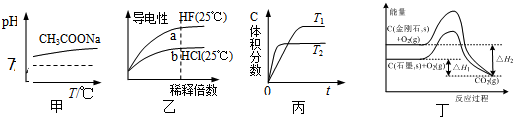

| A. | 由图甲可知,升高温度醋酸钠的水解程度增大 | |
| B. | 由图乙可知,a点Kw的数值比b点Kw的数值大 | |
| C. | 由图丙可知,反应A(g)+B(g)=2C(g)是吸热反应 | |
| D. | 由图丁可知,反应C(金刚石,s)=C(石墨,s)的焓变△H=△H1-△H2 |
13.短周期元素R、T、X、Y、Z在元素周期表的相对位置如表所示,它们的最外层电子数之和为24.则下列判断正确的是( )
| R | T | |
| X | Y | Z |
| A. | R位于元素周期表中第二周期第VIA族 | |
| B. | 五种元素中原子序数最大的是X | |
| C. | 气态氢化物稳定性:T>Y | |
| D. | Z元素的最高价氧化物对应的水化物的化学式为H2ZO4 |
10.某有机物的结构简式如图,下列关于该有机物的叙述正确的是( )
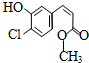

| A. | 该有机物的摩尔质量为200 | |
| B. | 该有机物属于芳香烃 | |
| C. | 该有机物可发生取代、加成、加聚、氧化、还原、消去反应 | |
| D. | 1 mol该有机物在适当条件下,最多可与4mol NaOH和4mol H2反应 |
17.下列仪器的使用、实验药品选择或实验现象描述正确的是( )
| A. | 苯、乙醇、四氯化碳都是重要有机溶剂,都可用于提取碘水中的碘单质 | |
| B. | 可用蘸浓硫酸的玻璃棒检验输送氨气的管道是否漏气 | |
| C. | 往装有铁钉的试管中加入2 mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,可以观察到铁钉表面粘附气泡,同时周围出现蓝色沉淀 | |
| D. | 用量筒量取10.00mL 1.0mol/L的盐酸于100mL溶量瓶中,加水稀释至刻度,可制得0.1mol/L的盐酸 |
7.在FeCl3和CuCl2的混合溶液中加入过量铁粉,反应完全后剩余固体的质量大于加入的铁粉质量.已知原混合溶液中FeCl3为0.4mol,则CuCl2的物质的量可能是( )
| A. | 0.2 mol | B. | 0.6 mol | C. | 1.2 mol | D. | 2 mol |
14.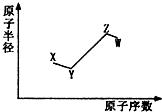 短周期非金属主族元素X、Y、Z、W,它们的原子半径与原子序数的关系如图所示.其中Z元素原子序数是Y的2倍,原子最外层电子数与X元素原子核外电子数相等,下列说法一定正确的是( )
短周期非金属主族元素X、Y、Z、W,它们的原子半径与原子序数的关系如图所示.其中Z元素原子序数是Y的2倍,原子最外层电子数与X元素原子核外电子数相等,下列说法一定正确的是( )
 短周期非金属主族元素X、Y、Z、W,它们的原子半径与原子序数的关系如图所示.其中Z元素原子序数是Y的2倍,原子最外层电子数与X元素原子核外电子数相等,下列说法一定正确的是( )
短周期非金属主族元素X、Y、Z、W,它们的原子半径与原子序数的关系如图所示.其中Z元素原子序数是Y的2倍,原子最外层电子数与X元素原子核外电子数相等,下列说法一定正确的是( )| A. | X和Z、Y和W处于同一主族 | |
| B. | 4种元素形成的各种单质中,Z单质的沸点最高 | |
| C. | W单质与X、Y、Z的最简单氢化物都可以发生反应 | |
| D. | 元素氧化物所对应的水化物酸性:W>Z>X |
11.化学与生产、生活密切相关,下列说法正确的是( )
| A. | 玻璃钢是钢与玻璃纤维形成的复合材料 | |
| B. | 氮氧化物是形成光化学烟雾和酸雨的一个重要原因 | |
| C. | 石油化工废弃物易造成水体富营养化 | |
| D. | 硫酸铵是常用的一种硝态氮肥 |
 X、Y、Z为前四周期元素,且原子序数依次增大.X与氢元素可形成:H2X、H2X2两种化合物,且在常温下均为液态;Y基态原子的M层电子数是K层的3倍;Z2+的3d轨道中有10个电子.请回答下列问题:
X、Y、Z为前四周期元素,且原子序数依次增大.X与氢元素可形成:H2X、H2X2两种化合物,且在常温下均为液态;Y基态原子的M层电子数是K层的3倍;Z2+的3d轨道中有10个电子.请回答下列问题: