题目内容
2.从化学角度分析,下列叙述不正确的是( )| A. | 银氨溶液或新制Cu(OH)2均能检验糖尿病人尿液中的葡萄糖 | |
| B. | 在燃煤中加入适量生石灰,可以减少二氧化硫的排放 | |
| C. | 铜制品在潮湿环境中的腐蚀比干燥环境中快 | |
| D. | 生活中的水杯、奶瓶、食物保鲜膜等可以使用聚氯乙烯来制造 |
分析 A.葡萄糖含有醛基,可发生氧化反应;
B.二氧化硫为酸性氧化物,可与生石灰反应;
C.潮湿环境中易发生电化学腐蚀;
D.聚氯乙烯中的增塑剂对人体有害.
解答 解:A.葡萄糖含有醛基,可与银氨溶液或新制Cu(OH)2发生氧化反应,故A正确;
B.二氧化硫为酸性氧化物,可与生石灰反应,最终产物为硫酸钙,可减少污染性气体的排放,有效防治酸雨,故B正确;
C.潮湿环境中易发生电化学腐蚀,电化学腐蚀较化学腐蚀快,故C正确;
D.聚氯乙烯中的增塑剂对人体有害,且释放出氯化氢,一般不能用于生活中的水杯、奶瓶、食物保鲜膜等,可用聚乙烯材料,故D错误.
故选D.
点评 本题考查化学有机物的结构和性质,为高考常见题型,侧重于化学与生活、生产和环境的考查,难度不大,注意相关知识的积累.

练习册系列答案
 一本好题口算题卡系列答案
一本好题口算题卡系列答案
相关题目
12.以硫铁矿为原料生产硫酸所得的酸性废水中砷元素含量极高,为控制砷的排放,用化学沉降法处理含砷废水,相关数据如下表.
回答以下问题:
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=0.2mol•L-1.
(2)写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]=c3(Ca2+)•c2(AsO43-),若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol•L-1,c(AsO43-)的最大是7.2×10-17mol•L-1.
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式2H++MnO2+H3AsO3=H3AsO4+Mn2++H2O.
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降.
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为CaSO4;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为H3AsO4是弱酸,当溶液中pH调节到8左右时AsO43-浓度增大,Ca3(AsO4)2开始沉淀.
| 表1.几种砷酸盐的Ksp | |
| 难溶物 | Ksp |
| Ca3(AsO4)2 | 6.8×10-9 |
| AlAsO4 | 1.6×10-16 |
| FeAsO4 | 7.2×10-21 |
| 表2.工厂污染物排放浓度及允许排放标准 | ||
| 污染物 | H2SO4 | As |
| 浓度 | 19.6g/L | 1.6g•L-1 |
| 排放标准 | pH6~9 | 0.5mg•L-1 |
(1)该硫酸工厂排放的废水中硫酸的物质的量浓度c(H2SO4)=0.2mol•L-1.
(2)写出难溶物Ca3(AsO4)2的Ksp表达式:Ksp[Ca3(AsO4)2]=c3(Ca2+)•c2(AsO43-),若混合溶液中Al3+、Fe3+的浓度均为1.0×10-4mol•L-1,c(AsO43-)的最大是7.2×10-17mol•L-1.
(3)工厂排放出的酸性废水中的三价砷(H3AsO3弱酸)不易沉降,可投入MnO2先将其氧化成五价砷(H3AsO4弱酸),写出该反应的离子方程式2H++MnO2+H3AsO3=H3AsO4+Mn2++H2O.
(4)在处理含砷废水时采用分段式,先向废水中投入生石灰调节pH到2,再投入生石灰将pH调节到8左右使五价砷以Ca3(AsO4)2形式沉降.
①将pH调节到2时废水中有大量沉淀产生,沉淀主要成分的化学式为CaSO4;
②Ca3(AsO4)2在pH调节到8左右才开始沉淀的原因为H3AsO4是弱酸,当溶液中pH调节到8左右时AsO43-浓度增大,Ca3(AsO4)2开始沉淀.
13. M、X、Y、Z是四种常见的短周期元素,各元素在周期表中的位置如图所示,其中只有M属于金属元素.下列说法中,错误的是( )
M、X、Y、Z是四种常见的短周期元素,各元素在周期表中的位置如图所示,其中只有M属于金属元素.下列说法中,错误的是( )
 M、X、Y、Z是四种常见的短周期元素,各元素在周期表中的位置如图所示,其中只有M属于金属元素.下列说法中,错误的是( )
M、X、Y、Z是四种常见的短周期元素,各元素在周期表中的位置如图所示,其中只有M属于金属元素.下列说法中,错误的是( )| A. | X元素最高价氧化物对应水化物的酸性弱于Y元素的 | |
| B. | Y元素气态氢化物的稳定性大于Z元素的 | |
| C. | 元素Z在周期表中的位置为第2周期、VIA族 | |
| D. | M元素的氧化物既可以与强酸溶液反应,也可以与强碱溶液反应 |
17.对如图两种化合物的结构或性质描述正确的是( )


| A. | 互为同分异构体 | B. | 均能与Na反应且产物相同 | ||
| C. | 均可发生取代反应和加成反应 | D. | 分子中共平面的碳原子数相同 |
14.铜和铜的化合物是重要的化工原料,常用作催化剂、防腐剂和消毒剂等制备合成.已知:CuCl2溶液与乙二胺(H2N-CH2-CH2-NH2)可形成配离子[Cu(En)2]2+(En是乙二胺的简写):(见图1)

(1)配离子[Cu(En)2]2+的中心离子基态外围电子排布式为3d9;乙二胺分子中氮原子轨道的杂化类型为sp3;配离子[Cu(En)2]2+中的配位数为4;
(2)乙二胺和三甲胺[N(CH3)3]均属于胺类,但乙二胺比三甲胺的沸点高的多,原因是乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键;
(3)比较表中有大小(用“大于”或“小于”“等于”填空)
(4)氯和钾与不同价态的铜可形成两种化合物M和N,二都均可用于催化乙炔聚合,二者阴离子均为无限长链结构(见图2),下列分析正确的是BC.
A、图中a位置上Cl原子为sp杂化轨道;
B、M的化学式确认是KCuCl3,则N的化学式为K2CuCl3;
C、配离子[CuCl4]2-和配离子[AlCl4]-空间结构相似;
金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子反应方程式为Cu+H2O2 +4NH3═Cu(NH3)42++2OH-;
(5)金属铁单质的晶体在不同温度下有两种堆积方式(晶胞分别如图3所示).已知体心立方与面心立方的晶胞堆积的空间利用率分别为68%和74%.列算式计算两种晶体的密度之比[ρ(a):ρ(b)]为3$\sqrt{3}$:4$\sqrt{2}$(化简成简单的关系式,不求计算结果,只填写结果不得分).

(1)配离子[Cu(En)2]2+的中心离子基态外围电子排布式为3d9;乙二胺分子中氮原子轨道的杂化类型为sp3;配离子[Cu(En)2]2+中的配位数为4;
(2)乙二胺和三甲胺[N(CH3)3]均属于胺类,但乙二胺比三甲胺的沸点高的多,原因是乙二胺分子之间可以形成氢键,三甲胺分子之间不能形成氢键;
(3)比较表中有大小(用“大于”或“小于”“等于”填空)
| 第一电离能 | 离子半径 | 熔点 | 酸性 |
| P>S | H->Li+ | KCl<Si | HClO3<HClO4 |
A、图中a位置上Cl原子为sp杂化轨道;
B、M的化学式确认是KCuCl3,则N的化学式为K2CuCl3;
C、配离子[CuCl4]2-和配离子[AlCl4]-空间结构相似;
金属铜单独与氨水或单独与过氧化氢都不能反应,但可与氨水和过氧化氢的混合溶液反应,反应的离子反应方程式为Cu+H2O2 +4NH3═Cu(NH3)42++2OH-;
(5)金属铁单质的晶体在不同温度下有两种堆积方式(晶胞分别如图3所示).已知体心立方与面心立方的晶胞堆积的空间利用率分别为68%和74%.列算式计算两种晶体的密度之比[ρ(a):ρ(b)]为3$\sqrt{3}$:4$\sqrt{2}$(化简成简单的关系式,不求计算结果,只填写结果不得分).
12.下列说法正确的是( )

| A. | 由图甲可知,升高温度醋酸钠的水解程度增大 | |
| B. | 由图乙可知,a点Kw的数值比b点Kw的数值大 | |
| C. | 由图丙可知,反应A(g)+B(g)=2C(g)是吸热反应 | |
| D. | 由图丁可知,反应C(金刚石,s)=C(石墨,s)的焓变△H=△H1-△H2 |
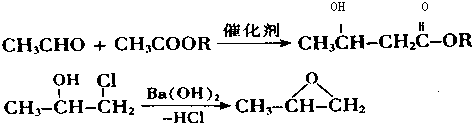
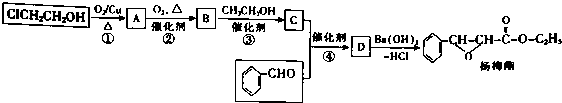
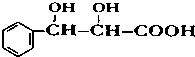 . 下列有关该物质的叙述中,正确的是CD.
. 下列有关该物质的叙述中,正确的是CD.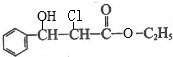 .
. 等.
等.

 .
.  .
.