题目内容
7.兴趣小组的同学为测定某一铁铜合金样品中铁的质量分数,取6g该合金粉末样品向其中加入硫酸铜溶液160g,二者恰好完全反应,过滤得固体铜6.8g.计算:(1)该合金样品中铁的质量分数.(计算结果精确至0.1%)
(2)所得硫酸亚铁溶液的质量.
分析 合金加入到硫酸铜溶液中发生Fe+CuSO4=FeSO4+Cu,过滤得固体铜6.8g,说明铁完全反应,结合反应化学方程式计算.
解答 解:设样品中铜的质量为x.
Fe+CuSO4=FeSO4+Cu
56 64
6 g-x 6.8 g-x
$\frac{56}{6g-x}=\frac{64}{6.8g-x}$,x=0.4g,
(1)样品中铁的质量分数=$\frac{6g-0.4g}{6g}×100%$=93.3%,
答:该合金样品中铁的质量分数为93.3%;
(2)合金中铁的质量为6g-0.4g=5.6g,
所得硫酸亚铁溶液的质量为5.6g+160g-6.4g=159.2 g,
答:所得硫酸亚铁溶液的质量为159.2 g.
点评 本题考查混合物的计算,为高频考点,侧重于学生的分析、计算能力的考查,注意把握反应的方程式,结合方程式计算,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.对如图两种化合物的结构或性质描述正确的是( )


| A. | 互为同分异构体 | B. | 均能与Na反应且产物相同 | ||
| C. | 均可发生取代反应和加成反应 | D. | 分子中共平面的碳原子数相同 |
15.在中考体育考试中,很多学生在测试结束后感觉小腿酸痛,这是因为在剧烈的高强度运动中,人体内的葡萄糖(C6H12O6)会进行无氧反应,产生乳酸(C3H6O3),下列说法正确的是( )
| A. | 乳酸是一种氧化物 | |
| B. | 1个乳酸分子是由3个碳原子和3个水分子构成 | |
| C. | 葡萄糖与乳酸中所含的原子种类相同 | |
| D. | 葡萄糖不能为人体提供能量 |
12.下列说法正确的是( )

| A. | 由图甲可知,升高温度醋酸钠的水解程度增大 | |
| B. | 由图乙可知,a点Kw的数值比b点Kw的数值大 | |
| C. | 由图丙可知,反应A(g)+B(g)=2C(g)是吸热反应 | |
| D. | 由图丁可知,反应C(金刚石,s)=C(石墨,s)的焓变△H=△H1-△H2 |
19.设NA为阿伏加德罗常数的值,N表示粒子数.下列说法正确的是( )
| A. | 0.1 mol苯乙烯中含有碳碳双键的数目为0.4NA | |
| B. | 将1molCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2[NA-N(Cl2)] | |
| C. | 一定条件下,0.1 mol SO2与足量氧气反应生成SO3,转移电子数为0.2NA | |
| D. | 电解精炼铜,当电路中通过的电子数目为0.2NA时,阳极质量减少6.4g |
17.下列仪器的使用、实验药品选择或实验现象描述正确的是( )
| A. | 苯、乙醇、四氯化碳都是重要有机溶剂,都可用于提取碘水中的碘单质 | |
| B. | 可用蘸浓硫酸的玻璃棒检验输送氨气的管道是否漏气 | |
| C. | 往装有铁钉的试管中加入2 mL水、3滴稀醋酸和1滴K3[Fe(CN)6]溶液,可以观察到铁钉表面粘附气泡,同时周围出现蓝色沉淀 | |
| D. | 用量筒量取10.00mL 1.0mol/L的盐酸于100mL溶量瓶中,加水稀释至刻度,可制得0.1mol/L的盐酸 |
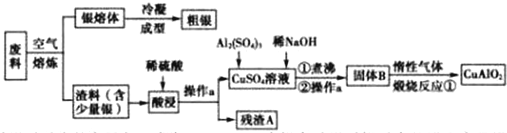
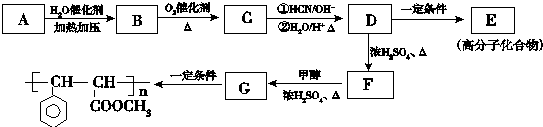
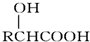
 .
. .
.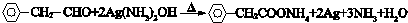 .
. .
.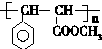 与足量氢氧化钠溶液反应的化学方程式
与足量氢氧化钠溶液反应的化学方程式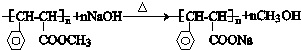 .
.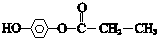 .
.