题目内容
【题目】N2O和CO是环境污染性气体,可在催化条件下转化为无害气体,反应进程中的能量变化如图所示。下列说法正确的是

A. 加入催化剂使反应的△H变小
B. 该反应的热化学方程式为:N2O(g)+CO(g)===CO2(g)+N2(g) △H= - 226 kJ·mol-1
C. 反应物的总键能大于生成物的总键能
D. 该反应正反应的活化能大于逆反应的活化能
【答案】B
【解析】
A.对于特定化学反应,加入催化剂只是改变化学反应途径,不改变化学反应的反应热,错误;
B.Ea1=134kJ/mol,Ea2=360kJ/mol,则该反应的热化学方程式为:N2O(g)+CO(g)=CO2(g)+N2(g) △H=134kJ/mol-360kJ/mol= - 226 kJ·mol-1,正确;
C.该反应反应物总能量高于生成物总能量,故该反应为放热反应,错误;
D.该反应正反应的活化能为134kJ/mol,逆反应的活化能为360kJ/mol,即该反应逆反应的活化能大于正反应的活化能,错误。答案选B。

 轻松课堂单元期中期末专题冲刺100分系列答案
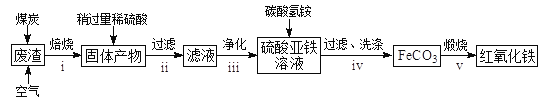
轻松课堂单元期中期末专题冲刺100分系列答案【题目】绿矾(FeSO4·7H2O)在工业上可用于制造铁盐、氧化铁红及靛青等。下面是以市售铁屑(含少量锡、氧化铁等杂质)为原料生产纯净绿矾的一种方法:

25℃ | pH值 |
饱和H2S溶液 | 3.9 |
SnS沉淀完全 | 1.6 |
FeS开始沉淀 | 3.0 |
FeS开始沉淀 | 5.5 |
(1)检验制得的绿矾晶体中是否含有Fe3+,最好选用的试剂为________。
A.KSCN溶液 B.NaOH溶液 C.KMnO4溶液 D.苯酚溶液
(2)操作Ⅱ中,通入硫化氢至饱和的目的是______________________________________;在溶液中用硫酸酸化至pH=2的目的是__________________________________。
(3)操作Ⅳ的顺序依次为_________________、冷却结晶、____________________。
(4)操作Ⅳ得到的绿矾晶体用少量冰水洗涤,其目的是:①除去晶体表面附着的硫酸等杂质;②_________________________________________________________。
(5)测定绿矾产品中Fe2+含量的方法是:a.称取2.850 g绿矾产品,溶解,在250 mL容量瓶中定容;b.量取25.00 mL待测溶液于锥形瓶中;c.用硫酸酸化的0.010 00 mol·L-1 KMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为20.00 mL。
①滴定时盛放KMnO4溶液的仪器为________________________(填仪器名称)。
②计算上述样品中FeSO4·7H2O的质量分数为____________________。