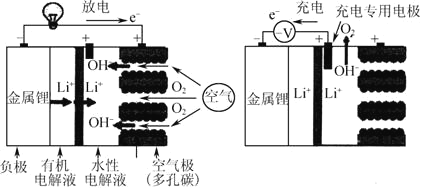
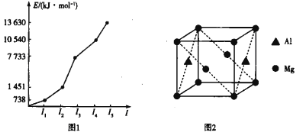
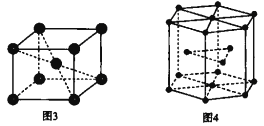
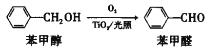题目内容
【题目】水溶液中的离子平衡是中学学习的一个重要内容。
(1)下列溶液①0.1mol/L盐酸②0.1mol/L H2SO4溶液③0.1mol/LCH3COONa溶液④0.1mol/LNH4Cl溶液⑤0.1mol/L氨水,按pH由小到大顺序为_________________(填序号)
(2)等浓度的盐酸、氨水中,由水电离出的H+浓度c(H+)盐酸_________ c(H+)氨水(填“大于”“小于”或“等于”)。在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合充分反应后溶液呈中性。则反应后溶液存在的离子浓度由大到小顺序为_________,氨水的浓度a_______0.01 mol·L-1(填“>”、“<”或“=”)
(3)某同学查阅资料发现,人体血液里存在重要的酸碱平衡:CO2+H2OH2CO3![]() HCO3﹣,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。
HCO3﹣,使人体血液pH保持在7.35~7.45,否则就会发生酸中毒或碱中毒。
①人体血液酸中毒时,可注射_____(填选项)缓解;
A.NaOH溶液 B.NaHCO3溶液 C.NaCl溶液 D.Na2SO4溶液
②已知25℃时,![]() 水解反应的一级平衡常数
水解反应的一级平衡常数![]() ,当溶液中
,当溶液中![]() 时,溶液的pH=_________________。
时,溶液的pH=_________________。
(4)25℃时,AgCl的Ksp=1.8×10﹣10,该温度下向1 L 0.03 mol/L的AgNO3溶液中加入1 L 0.01 mol/L的NaCl溶液之后,溶液中c(Cl﹣)=_____mol/L(忽略混合前后溶液体积的变化)。平衡后,若向该体系中加入少量AgCl固体,则c(Cl﹣)_____(填“增大”或“减小”或“不变”)。
【答案】②①④③⑤ 小于 ![]() > B 10 1.8×10﹣8 不变
> B 10 1.8×10﹣8 不变
【解析】
⑴分开显酸性和显碱性的物质,再分析显酸性的物质中的氢离子浓度,再分析显碱性的物质中的氢氧根浓度,最后得出结论。
⑵盐酸电离出的氢离子浓度大于氨水电离出的氢氧根浓度,则盐酸抑制水电离程度大,在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合充分反应后溶液呈中性,根据电荷守恒和呈中性得出离子浓度由大到小顺序,分析反应后溶液中溶质,说明氨水未反应完,得出氨水的浓度大小关系。
⑶①A.NaOH溶液是强碱且具有强烈的腐蚀性;B.NaHCO3溶液水解显碱性,可以和酸反应起到缓解人体血液酸中毒;C.NaCl溶液,D.Na2SO4溶液都呈中性,不能缓解人体血液酸中毒;②已知25℃时,根据水解平衡常数和溶液中![]() 时,计算氢氧根浓度,再计算氢离子浓度,再算pH。
时,计算氢氧根浓度,再计算氢离子浓度,再算pH。
⑷25℃时,该温度下向1 L 0.03 mol/L的AgNO3溶液中加入1 L 0.01 mol/L的NaCl溶液之后,氯离子沉淀,硝酸银过量,根据溶度积常数和银离子浓度计算氯离子浓度。
⑴显酸性的有①0.1mol/L盐酸,②0.1mol/L H2SO4溶液,④0.1mol/LNH4Cl溶液,显碱性的有③0.1mol/LCH3COONa溶液,⑤0.1mol/L氨水。①0.1mol/L盐酸,②0.1mol/L H2SO4溶液都是电离显酸性,且硫酸为二元酸,电离出的氢离子浓度是盐酸电离出的氢离子浓度二倍,酸性强,pH小,④0.1mol/LNH4Cl溶液是水解显酸性,电离出的氢离子浓度比盐酸中电离出的氢离子小,pH大,因此这三者pH顺序为② < ① < ④,③0.1mol/LCH3COONa溶液是水解显碱性,⑤0.1mol/L氨水是电离显碱性,电离出的氢氧根浓度大于③中氢氧根浓度,碱性强,pH大,因此这两者的pH顺序为③ < ⑤,因此pH由小到大顺序为②<①<④<③<⑤;故答案为:②①④③⑤。
⑵等浓度的盐酸、氨水中,盐酸电离出的氢离子浓度大于氨水电离出的氢氧根浓度,则盐酸抑制水电离程度大,因此由水电离出的c(H+)是盐酸小于氨水。在25℃下,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合充分反应后溶液呈中性,则铵根和氯离子浓度相等,氢离子和氢氧根离子浓度相等,氯离子浓度大于氢离子浓度,因此反应后溶液存在的离子浓度由大到小顺序为![]() ,溶液溶质应该是氯化铵和一水合氨的混合物,氨水未反应完,因此氨水的浓度a>0.01 mol·L-1,故答案为:小于;
,溶液溶质应该是氯化铵和一水合氨的混合物,氨水未反应完,因此氨水的浓度a>0.01 mol·L-1,故答案为:小于;![]() ;>。
;>。
⑶①A.NaOH溶液是强碱且具有强烈的腐蚀性,故A不符合题意;B.NaHCO3溶液水解显碱性,可以和酸反应起到缓解人体血液酸中毒,故B符合题意;C.NaCl溶液,D.Na2SO4溶液都呈中性,不能缓解人体血液酸中毒,故CD不符合题意;综上所述,答案为B。
②当溶液中![]() 时,
时,![]() ,
,![]() ,
,![]() ,
,![]() ,因此溶液的pH=10;故答案为:10。
,因此溶液的pH=10;故答案为:10。
⑷25℃时,该温度下向1 L 0.03 mol/L的AgNO3溶液中加入1 L 0.01 mol/L的NaCl溶液之后,氯离子沉淀,硝酸银过量,因此溶液中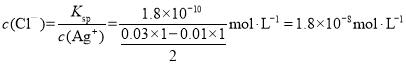 ,平衡后,AgCl形成沉淀溶解平衡体系,加入氯化银固体不影响平衡,因此c(Cl-)不变;故答案为:
,平衡后,AgCl形成沉淀溶解平衡体系,加入氯化银固体不影响平衡,因此c(Cl-)不变;故答案为:![]() ;不变。
;不变。

【题目】下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
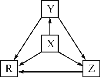
选项 | X | Y | Z | R |
A | Al | AlCl3 | Al(OH)3 | NaAlO2 |
B | Na | Na2O | Na2O2 | NaOH |
C | H2S | S | SO2 | SO3 |
D | N2 | NH3 | NO | NO2 |
A.AB.BC.CD.D
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)PCl3(g)+Cl2(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在50s时的速率v(PCl3)=0.0016molL﹣1s﹣1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11molL﹣1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0molPCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%