题目内容
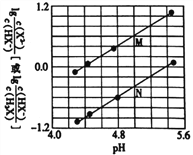
【题目】环境监察局常用“定电位”NOx传感器来监测化工厂的氮氧化物气体是否达到排放标准,其工作原理如图所示.下列说法正确的是( )
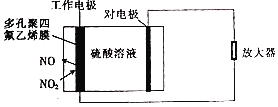
A.“对电极”是正极
B.“工作电极”上发生的电极反应为NO2+2H+-2e﹣═NO+H2O
C.传感器工作时,H+由“工作电极”移向“对电极”
D.“对电极”的材料可能为活泼金属锌
【答案】D
【解析】
A. 工作电极是NO2变为NO,化合价降低,是原电池的正极,对电极为负极,故A错误;
B. “工作电极”上发生的电极反应为NO2+2H+ + 2e- = NO+H2O,故B错误;
C. 传感器工作时,根据“同性相吸”理解得到H+由“对电极”移向 “工作电极”,故C错误;
D. 对电极为负极,“对电极”的材料可能为活泼金属锌,故D正确。
综上所述,答案为D。

练习册系列答案
相关题目
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)PCl3(g)+Cl2(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在50s时的速率v(PCl3)=0.0016molL﹣1s﹣1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11molL﹣1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0molPCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%