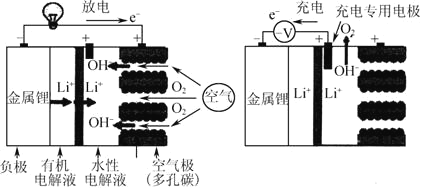
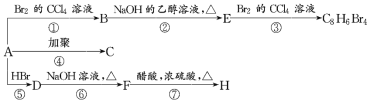
题目内容
【题目】浅绿色的硫酸亚铁铵晶体[又名莫尔盐,(NH4)2SO4·FeSO4·6H2O]比绿矾(FeSO4·7H2O)更稳定,常用于定量分析。莫尔盐的一种实验室制法如下:
废铁屑![]()
![]() 溶液A
溶液A![]()
![]()
![]() 莫尔盐
莫尔盐
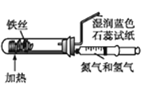
(1)向废铁屑中加入稀硫酸后,并不等铁屑完全溶解而是剩余少量时就进行过滤,其目的是___;证明溶液A不含Fe3+的最佳试剂是___(填序号字母)。
A 酚酞溶液 B KSCN溶液
C 烧碱溶液 D KMnO4溶液
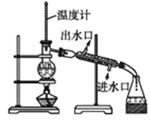
操作Ⅰ的步骤是:加热蒸发、___、过滤。
(2)操作Ⅰ得到的莫尔盐晶体用少量乙醇淋洗,其目的是:①除去晶体表面附着的硫酸、水等杂质②______。
(3)用托盘天平称量(NH4)2SO4晶体,晶体要放在天平___(填“左”或“右”)盘。
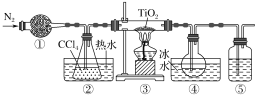
(4)从下列装置中选取必要的装置制取(NH4)2SO4溶液,连接的顺序(用接口序号字母表示)是:a接___;__接___。
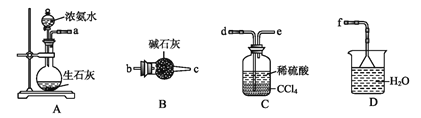
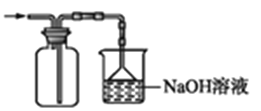
将装置C中两种液体分离开的操作名称是____。装置D的作用是__。
【答案】防止Fe2+被氧化为F![]() B 冷却结晶 减少莫尔盐晶体洗涤中的损耗 左 d e f 分液 吸收多余的NH3防止污染空气,防止倒吸
B 冷却结晶 减少莫尔盐晶体洗涤中的损耗 左 d e f 分液 吸收多余的NH3防止污染空气,防止倒吸
【解析】
废铁屑加稀硫酸溶解,得到硫酸亚铁溶液A,加硫酸铵晶体共同溶解,经过蒸发浓缩、冷却晶体、过滤、洗涤、干燥得到莫尔盐,据此解答。
(1)Fe2+不稳定,易被氧气氧化为Fe3+,剩余少量铁粉防止Fe2+被氧化为Fe3+;检验三价铁离子用KSCN溶液,如果含有三价铁离子溶液呈红色;操作I是从溶液中获得晶体,其操作为加热蒸发、冷却结晶、过滤;故本题答案为:防止Fe2+被氧化为Fe3+;B;冷却结晶;
(2)洗涤的目的应从两个角度回答:①洗去滤渣中的一些杂质;②防止滤渣溶于洗涤液而损耗,故本题答案为:减少莫尔盐晶体洗涤中的损耗;
(3)遵循“左物右码”原则,药品应放置在左盘内,故本题答案为:左;
(4)制取的氨气与硫酸反应生成硫酸铵,剩余的氨气用水吸收,连接顺序为a→d→e→f,
故本题答案为:d;e;f;
(5)分离互不相溶的液体的方法是:分液;氨气有刺激性气味,污染空气,用水吸收多余的氨气防止污染空气,加倒置的漏斗防止倒吸;故本题答案为:分液;吸收多余的NH3防止污染空气,防止倒吸。

【题目】下列各组物质中,物质之间通过一步反应就能实现如图所示转化的是( )
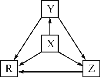
选项 | X | Y | Z | R |
A | Al | AlCl3 | Al(OH)3 | NaAlO2 |
B | Na | Na2O | Na2O2 | NaOH |
C | H2S | S | SO2 | SO3 |
D | N2 | NH3 | NO | NO2 |
A.AB.BC.CD.D
【题目】温度为T时,向2.0L恒容密闭容器中充入1.0mol PCl5,反应PCl5(g)PCl3(g)+Cl2(g),经过一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.16 | 0.19 | 0.20 | 0.20 |
下列说法正确的是( )
A.反应在50s时的速率v(PCl3)=0.0016molL﹣1s﹣1
B.保持其他条件不变,升高温度,平衡时c(PCl3)=0.11molL﹣1,则反应的△H<0
C.相同温度下,起始时向容器中充入1.0molPCl5、0.20molPCl3和0.20molCl2,反应达到平衡前v(正)>v(逆)
D.相同温度下,起始时向容器中充入2.0molPCl3和2.0molCl2,达到平衡时,PCl3的转化率小于80%