题目内容
【题目】K2Cr2O7是一种重要的化工原料。以铬铁矿(主要成分为FeO·Cr2O3,还含有Al2O3、Fe2O等杂质)为原料制备K2Cr2O7的一种工艺流程如下:

已知:(a) Cr2O72-+H2O![]() 2CrO42-+2H+
2CrO42-+2H+
(b)不同温度下各物质的溶解度
物 质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
溶解度(g/100g H2O) | 0℃ | 28 | 35.7 | 4.7 | 163 |
40℃ | 40.1 | 36.4 | 26.3 | 215 | |
80℃ | 51.3 | 38 | 70 | 376 | |
(c)步骤①的主要反应为:FeOCr2O3+Na2CO3+NaNO3![]() Na2CrO4+Fe2O3+CO2+NaNO2(未配平)。
Na2CrO4+Fe2O3+CO2+NaNO2(未配平)。
(1) “滤渣1”和 “滤渣2”的主要成分分别是_________,_________(填化学式).
写出③的离子反应方程式________________________________________;
步骤④中调PH可选用以下试剂__________。
A、NH3 B、 KOH C、CH3COOH D、 HCl
(2)在步骤⑤中加入适量KCl,____________________,过滤得到K2Cr2O7固体。
(3)某工厂用akg 铬铁矿粉(含Cr2O3 40%)制K2Cr2O7,最终得到产品 b kg,产率为_____________________________×100%。(列计算式)。
(4)化还原法可除去废水中的Cr2O72-,取含Cr2O72-的模拟水样分别在不同PH条件下,向每个水样中分 别加一定量的FeSO4、NaHSO3,搅拌,充分反应,然后滴加Ca(OH)2悬浊液,静置沉淀,测定铬去除率,实验结果下图所示。
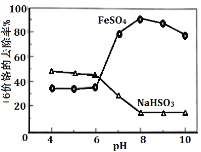
①在酸性条件下,NaHSO3使Cr2O72-还原成为Cr3+,请写出NaHSO3与Cr2O72-反应的离子方程式:____________________________________。
② pH>8时,亚铁盐对+6价Cr的去除效果反而下降,可能的原因是_________________。
【答案】Fe2O3Al(OH)3AlO2-+CO2+2H2O=A(OH)3↓+HCO3-C蒸发浓缩,冷却结晶b / (a ×0.4×294÷152)3HSO3-+Cr2O72-+5H+=2Cr3++3SO42-+4H2OpH>8时,Fe2+转化为Fe(OH)2而Fe(OH)2易被空气中O2氧化
【解析】
(1)因在步骤①发生的反应有:FeOCr2O3+Na2CO3+NaNO3![]() Na2CrO4+Fe2O3+CO2+NaNO2(未配平),Al2O3+Na2CO3
Na2CrO4+Fe2O3+CO2+NaNO2(未配平),Al2O3+Na2CO3![]() NaAlO2+CO2(未配平),在步骤④中调PH是增大溶液中氢离子浓度,而盐酸易被氧化,只能用CH3COOH,故答案为:Fe2O3;Al(OH)3;AlO2-+CO2+2H2O=A(OH)3↓+HCO3-;C;(2)因K2Cr2O7溶解度随温度降低而减小,则在在步骤⑤中加入适量KCl后,应蒸发浓缩,冷却结晶的方法来得到K2Cr2O7晶体,故答案为:蒸发浓缩,冷却结晶;(3)根据铬元素的质量守恒可得关系式:Cr2O3 ~K2Cr2O7,akg 铬铁矿粉(含Cr2O3 40%)理论上可制得K2Cr2O7质量为
NaAlO2+CO2(未配平),在步骤④中调PH是增大溶液中氢离子浓度,而盐酸易被氧化,只能用CH3COOH,故答案为:Fe2O3;Al(OH)3;AlO2-+CO2+2H2O=A(OH)3↓+HCO3-;C;(2)因K2Cr2O7溶解度随温度降低而减小,则在在步骤⑤中加入适量KCl后,应蒸发浓缩,冷却结晶的方法来得到K2Cr2O7晶体,故答案为:蒸发浓缩,冷却结晶;(3)根据铬元素的质量守恒可得关系式:Cr2O3 ~K2Cr2O7,akg 铬铁矿粉(含Cr2O3 40%)理论上可制得K2Cr2O7质量为![]() g,产率为:(b÷
g,产率为:(b÷![]() )×100%,故答案为:b / (a ×0.4×294÷152);(4)①由氧化还原反得失电子数目守恒可得NaHSO3与Cr2O72-反应的离子方程式为:3HSO3-+Cr2O72-+5H+=2Cr3++3SO42-+4H2O;② pH>8时,Fe2+转化为Fe(OH)2后易被空气中的氧气氧化,从而对对+6价Cr的去除率下降,故答案为:pH>8时,Fe2+转化为Fe(OH)2而Fe(OH)2易被空气中O2氧化。
)×100%,故答案为:b / (a ×0.4×294÷152);(4)①由氧化还原反得失电子数目守恒可得NaHSO3与Cr2O72-反应的离子方程式为:3HSO3-+Cr2O72-+5H+=2Cr3++3SO42-+4H2O;② pH>8时,Fe2+转化为Fe(OH)2后易被空气中的氧气氧化,从而对对+6价Cr的去除率下降,故答案为:pH>8时,Fe2+转化为Fe(OH)2而Fe(OH)2易被空气中O2氧化。

【题目】(1)某同学为探究酸性KMnO4溶液和H2C2O4(草酸,二元弱酸)溶液的反应过程,进行如下实验。请完成以下问题:
①写出酸性KMnO4溶液和H2C2O4的离子方程式___________________________________。
②配制100mL0.0400mol·L-1的H2C2O4溶液,除用到托盘天平、药匙、烧杯、量筒、玻璃棒等仪器外,还必须用到的玻璃仪器是_______________________________________。
③将KMnO4溶液逐滴滴入一定体积的酸性H2C2O4溶液中(温度相同,并振荡),记录的现象如下:
滴入KMnO4溶液的次序 | KMnO4溶液紫色褪去所需的时间 |
先滴入第1滴 | 60s |
褪色后,再滴入第2滴 | 15s |
褪色后,再滴入第3滴 | 3s |
褪色后,再滴入第4滴 | 1s |
请分析KMnO4溶液褪色时间变化的可能原因___________________________________。
(2)![]() 和
和![]() 在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中
在溶液中可相互转化。室温下,初始浓度为1.0 mol·L-1的Na2CrO4溶液中![]() 随c(H+)的变化如图所示
随c(H+)的变化如图所示
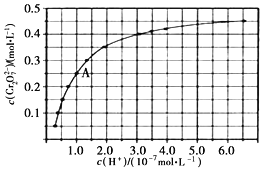
①用离子方程式表示溶液中![]() 和
和![]() 的转化反应_________。
的转化反应_________。
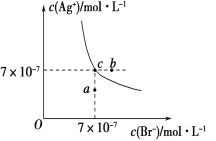
②由图可知,溶液酸性减小, ![]() 的平衡转化率_________(填“增大”“减小”或“不变”)。
的平衡转化率_________(填“增大”“减小”或“不变”)。
③升高温度,溶液中![]() 的平衡转化率减小,则该反应的ΔH_________0(填“大于”“小于”或“等于”)。
的平衡转化率减小,则该反应的ΔH_________0(填“大于”“小于”或“等于”)。