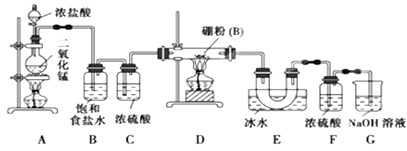
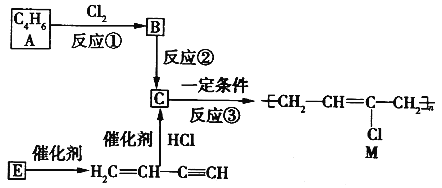
题目内容
【题目】明代《天工开物》记载“火法”冶炼锌:“炉甘石十斤,装载入一泥罐内,……然后逐层用煤炭饼垫盛,其底辅薪,发火煅红,……冷淀,毁罐取出,……即倭铅也”(注:炉甘石的主要成分为碳酸锌,泥罐中掺有煤炭)。下列说法不正确的是
A. 倭铅就是金属锌
B. 该冶炼锌的方法属于热还原法,煤炭中起作用的主要成分是C
C. 冶炼Zn的反应方程式为ZnCO3+2C![]() Zn+3CO↑
Zn+3CO↑
D. 能用类似于此方法冶炼的金属有:Mg、Fe、Cu
【答案】D
【解析】
A.炉甘石的主要成分为碳酸锌,则倭铅是指金属锌,故A正确;B.反应中C作还原剂,则煤炭中起作用的主要成分是C,故B正确;C.碳酸锌与碳在高温下反应生成锌和一氧化碳,方程式为:ZnCO3+2C![]() Zn+3CO↑,故C正确;D.金属镁采用的电解法进行冶炼,故D错误;答案选D。
Zn+3CO↑,故C正确;D.金属镁采用的电解法进行冶炼,故D错误;答案选D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】为了研究难溶盐的沉淀溶解平衡和沉淀转化,某同学设计如下实验。
步骤1:向2 mL 0.005 mol/LAgNO3溶液中加入2 mL 0.005 mol/LKSCN溶液,静置。 | 出现白色沉淀。 |
步骤2:取1 mL上层清液于试管中,滴加1滴2 mol/LFe(NO3)3溶液。 | 溶液变为红色。 |
步骤3:向步骤2的溶液中,继续加入5滴3 mol/LAgNO3溶液。 | 现象a,且溶液红色变浅。 |
步骤4:向步骤1余下的浊液中加入5滴3mol/L KI溶液。 | 出现黄色沉淀。 |
已知:25℃,Ksp(AgI,黄色)= 8.3×1017 ,Ksp (AgSCN,白色 )= 1.0×1012 。
回答下列问题:
(1)步骤3中现象a是________________________________。
(2)用沉淀溶解平衡原理解释步骤4的实验现象________________。
(3)向50 mL 0.005 mol/L的AgNO3溶液中加入150 mL0.005 mol/L的 KSCN溶液,若混合后溶液体积为200mL,则溶液中Ag+的浓度约为_____mol/L 。
【题目】K2Cr2O7是一种重要的化工原料。以铬铁矿(主要成分为FeO·Cr2O3,还含有Al2O3、Fe2O等杂质)为原料制备K2Cr2O7的一种工艺流程如下:

已知:(a) Cr2O72-+H2O![]() 2CrO42-+2H+
2CrO42-+2H+
(b)不同温度下各物质的溶解度
物 质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
溶解度(g/100g H2O) | 0℃ | 28 | 35.7 | 4.7 | 163 |
40℃ | 40.1 | 36.4 | 26.3 | 215 | |
80℃ | 51.3 | 38 | 70 | 376 | |
(c)步骤①的主要反应为:FeOCr2O3+Na2CO3+NaNO3![]() Na2CrO4+Fe2O3+CO2+NaNO2(未配平)。
Na2CrO4+Fe2O3+CO2+NaNO2(未配平)。
(1) “滤渣1”和 “滤渣2”的主要成分分别是_________,_________(填化学式).
写出③的离子反应方程式________________________________________;
步骤④中调PH可选用以下试剂__________。
A、NH3 B、 KOH C、CH3COOH D、 HCl
(2)在步骤⑤中加入适量KCl,____________________,过滤得到K2Cr2O7固体。
(3)某工厂用akg 铬铁矿粉(含Cr2O3 40%)制K2Cr2O7,最终得到产品 b kg,产率为_____________________________×100%。(列计算式)。
(4)化还原法可除去废水中的Cr2O72-,取含Cr2O72-的模拟水样分别在不同PH条件下,向每个水样中分 别加一定量的FeSO4、NaHSO3,搅拌,充分反应,然后滴加Ca(OH)2悬浊液,静置沉淀,测定铬去除率,实验结果下图所示。

①在酸性条件下,NaHSO3使Cr2O72-还原成为Cr3+,请写出NaHSO3与Cr2O72-反应的离子方程式:____________________________________。
② pH>8时,亚铁盐对+6价Cr的去除效果反而下降,可能的原因是_________________。