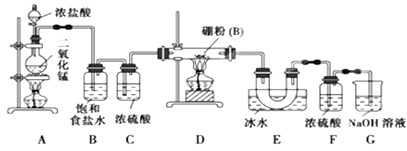
题目内容
【题目】分类是学习和研究化学的一种重要方法,下列分类合理的是
A.烧碱和纯碱都属于碱B.硫酸和盐酸都属于含氧酸
C.Na2SiO3和Na2SO4都属于钠盐D.Fe2O3和Al2O3都属于碱性氧化物
【答案】C
【解析】
A.烧碱是NaOH,是碱,而纯碱是碳酸钠的俗称,属于盐类,故A错误;
B.硫酸是含氧酸,而盐酸是无氧酸,故B错误;
C.Na2SiO3和Na2SO4电离时,均生成金属钠离子和酸根离子,属于钠盐,故C正确;
D.Al2O3能和酸反应,也能和碱反应,属于两性氧化物,故D错误;
故答案为C。

 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案【题目】K2Cr2O7是一种重要的化工原料。以铬铁矿(主要成分为FeO·Cr2O3,还含有Al2O3、Fe2O等杂质)为原料制备K2Cr2O7的一种工艺流程如下:

已知:(a) Cr2O72-+H2O![]() 2CrO42-+2H+
2CrO42-+2H+
(b)不同温度下各物质的溶解度
物 质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
溶解度(g/100g H2O) | 0℃ | 28 | 35.7 | 4.7 | 163 |
40℃ | 40.1 | 36.4 | 26.3 | 215 | |
80℃ | 51.3 | 38 | 70 | 376 | |
(c)步骤①的主要反应为:FeOCr2O3+Na2CO3+NaNO3![]() Na2CrO4+Fe2O3+CO2+NaNO2(未配平)。
Na2CrO4+Fe2O3+CO2+NaNO2(未配平)。
(1) “滤渣1”和 “滤渣2”的主要成分分别是_________,_________(填化学式).
写出③的离子反应方程式________________________________________;
步骤④中调PH可选用以下试剂__________。
A、NH3 B、 KOH C、CH3COOH D、 HCl
(2)在步骤⑤中加入适量KCl,____________________,过滤得到K2Cr2O7固体。
(3)某工厂用akg 铬铁矿粉(含Cr2O3 40%)制K2Cr2O7,最终得到产品 b kg,产率为_____________________________×100%。(列计算式)。
(4)化还原法可除去废水中的Cr2O72-,取含Cr2O72-的模拟水样分别在不同PH条件下,向每个水样中分 别加一定量的FeSO4、NaHSO3,搅拌,充分反应,然后滴加Ca(OH)2悬浊液,静置沉淀,测定铬去除率,实验结果下图所示。

①在酸性条件下,NaHSO3使Cr2O72-还原成为Cr3+,请写出NaHSO3与Cr2O72-反应的离子方程式:____________________________________。
② pH>8时,亚铁盐对+6价Cr的去除效果反而下降,可能的原因是_________________。