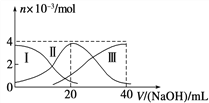
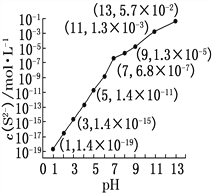题目内容
【题目】如图纵坐标代表沉淀的质量,横坐标代表加入溶液的体积,符合下列图像的是:

A.向硫酸溶液中加入氢氧化钡溶液
B.向碳酸氢钠溶液中加入氯化钙
C.向硫酸、硫酸镁、硫酸铝的混合溶液中逐滴加入氢氧化钠溶液直至过量
D.向氯化铝溶液中加入过量氢氧化钠溶液
【答案】C
【解析】
试题A、向硫酸溶液中加入氢氧化钡溶液发生反应:Ba(OH)2+ H2SO4 == BaSO4↓+ 2H2O,一开始就生成沉淀,与图像不符,错误;B、向碳酸氢钠溶液中加入氯化钙不发生反应,与图像不符,错误;C、向硫酸、硫酸镁、硫酸铝的混合溶液中逐滴加入氢氧化钠溶液直至过量发生的反应依次为H+ + OH-==H2O,Mg2+ + 2OH-==Mg(OH)2↓,Al3+ + 3OH-==Al(OH)3↓ 、Al(OH)3 + OH-==AlO2- + 2H2O,生成沉淀的情况与图像相符,正确;D、向氯化铝溶液中加入过量氢氧化钠溶液发生的反应依次为:AlCl3+3NaOH==Al(OH)3↓+3NaCl,Al(OH)3+NaOH==NaAlO2+2H2O,一开始就生成沉淀,最后消失,与图像不符,错误。

【题目】K2Cr2O7是一种重要的化工原料。以铬铁矿(主要成分为FeO·Cr2O3,还含有Al2O3、Fe2O等杂质)为原料制备K2Cr2O7的一种工艺流程如下:

已知:(a) Cr2O72-+H2O![]() 2CrO42-+2H+
2CrO42-+2H+
(b)不同温度下各物质的溶解度
物 质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
溶解度(g/100g H2O) | 0℃ | 28 | 35.7 | 4.7 | 163 |
40℃ | 40.1 | 36.4 | 26.3 | 215 | |
80℃ | 51.3 | 38 | 70 | 376 | |
(c)步骤①的主要反应为:FeOCr2O3+Na2CO3+NaNO3![]() Na2CrO4+Fe2O3+CO2+NaNO2(未配平)。
Na2CrO4+Fe2O3+CO2+NaNO2(未配平)。
(1) “滤渣1”和 “滤渣2”的主要成分分别是_________,_________(填化学式).
写出③的离子反应方程式________________________________________;
步骤④中调PH可选用以下试剂__________。
A、NH3 B、 KOH C、CH3COOH D、 HCl
(2)在步骤⑤中加入适量KCl,____________________,过滤得到K2Cr2O7固体。
(3)某工厂用akg 铬铁矿粉(含Cr2O3 40%)制K2Cr2O7,最终得到产品 b kg,产率为_____________________________×100%。(列计算式)。
(4)化还原法可除去废水中的Cr2O72-,取含Cr2O72-的模拟水样分别在不同PH条件下,向每个水样中分 别加一定量的FeSO4、NaHSO3,搅拌,充分反应,然后滴加Ca(OH)2悬浊液,静置沉淀,测定铬去除率,实验结果下图所示。
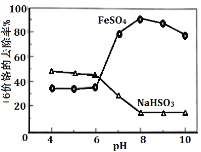
①在酸性条件下,NaHSO3使Cr2O72-还原成为Cr3+,请写出NaHSO3与Cr2O72-反应的离子方程式:____________________________________。
② pH>8时,亚铁盐对+6价Cr的去除效果反而下降,可能的原因是_________________。