题目内容
4.如图为实验室制备氯气及验证氯气与铝反应的装置图,E硬质玻璃管中装有铝箔;已知固体AlCl3易升华且极易与空气中的水蒸气反应.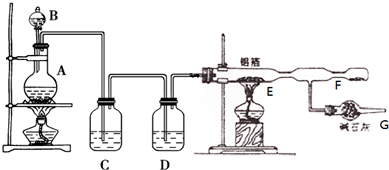
试回答:
(1)实验室制备氯气的离子反应方程式MnO2+4H++2Cl-△_△––––––Mn2++Cl2↑+2H2O.
(2)B装置的名称为分液漏斗 C中盛放的试剂是饱和氯化钠溶液.
(3)从A装置导出的气体若不经过C、D装置而直接进入E管,对实验产生的不良后果是未经除去的氯化氢和水蒸气随氯气进入E中和铝能反应生成氢气,氢气和氯气混合会发生爆炸.
(4)G装置所起的作用吸收多余的氯气,防止污染环境;防止空气中的水蒸气进入E中.
(5)E装置中发生反应的化学方程式为2Al+3Cl2加热_AlCl3.
(6)工业用电解饱和食盐水的方法来制取氯气,写出其反应的离子方程式2Cl-+2H2O通电_2OH-+H2↑+Cl2↑.
分析 (1)二氧化锰与浓盐酸反应生成氯化锰、水和氯气;
(2)依据图中B的形状说出其名称;浓盐酸易挥发,制取的氯气中含有氯化氢,应除去氯化氢杂质;
(3)混合气体中含有氯化氢、水蒸气、氯气,AlCl3易升华且极易与空气中的水蒸气反应,氢气和氯气混合会发生爆炸;
(4)氯气有毒,应进行尾气处理,能被氢氧化钠吸收,碱石灰为干燥剂能够防止空气中的水蒸气进入E中;
(5)氯气与铝反应生成氯化铝;
(6)电解食盐水生成NaOH、氢气、氯气.
解答 解:(1)二氧化锰与浓盐酸反应生成氯化锰、水和氯气,离子方程式:MnO2+4H++2Cl-△_Mn2++Cl2↑+2H2O;
故答案为:MnO2+4H++2Cl-△_Mn2++Cl2↑+2H2O;
(2)图中B为分液漏斗,浓盐酸易挥发,制取的氯气中含有氯化氢,氯化氢易溶于水,氯气在饱和食盐水中溶解度不大,可以用饱和食盐水除去氯气中等氯化氢;
故答案为:分液漏斗;饱和食盐水;
(3)因浓盐酸具有挥发性.反应生成物中有水,在加热条件下变成水蒸汽,所以混合气体中的成分是氯化氢、水蒸气、氯气;氯化氢和铝能反应生成氢气,氢气和氯气混合会发生爆炸.
故答案为:未经除去的氯化氢和水蒸气随氯气进入D中和铝能反应生成氢气,氢气和氯气混合会发生爆炸;
(4)氯气有毒,污染环境,所以不能排空;碱石灰的成分是氧化钙和氢氧化钠,氯气和氧化钙、氢氧化钠能反应达到,所以可用碱石灰处理尾气;空气中有水蒸气,碱石灰还能吸收水蒸气,所以可作干燥剂.
故答案为:吸收多余的氯气,防止污染环境;防止空气中的水蒸气进入D中;
(5)氯气与铝反应生成氯化铝,方程式:2Al+3Cl2加热_AlCl3,
故答案为:2Al+3Cl2加热_AlCl3;
(6)电解食盐水生成NaOH、氢气、氯气,离子反应为2Cl-+2H2O通电_2OH-+H2↑+Cl2↑,
故答案为:2Cl-+2H2O通电_2OH-+H2↑+Cl2↑.
点评 本题通过氯化铝的制取,考查了氯气的制备和性质的检验,熟悉反应原理是解题关键,题目难度不大.

 期末冲刺100分创新金卷完全试卷系列答案
期末冲刺100分创新金卷完全试卷系列答案①除去乙烷中少量的乙烯:通入酸性高锰酸钾溶液,气液分离;
②除去乙酸乙酯中少量的乙酸:用饱和碳酸钠溶液洗涤,分液、干燥、蒸馏;
③除去CO2中少量的SO2:气体通过盛饱和碳酸钠溶液的洗气瓶;
④除去乙醇中少量的乙酸:加足量生石灰,蒸馏.
| A. | ①② | B. | ②④ | C. | ③④ | D. | ②③ |
| A. | 常温常压下,将0.5molHI气体和0.5molCl2混合后,气体的分子总数为NA | |
| B. | 标准状况下,11.2L的SO3所含分子数为0.5NA | |
| C. | 质量为7.8g的Na2S和Na2O2组成的固体混合物中含有的阴离子数总数为0.1NA | |
| D. | 某密闭容器盛有0.1molN2和0.3molH2,在一定条件下充分反应,转移电子的数目为0.6NA |
| A. | 绿色化学的核心是应用化学原理对环境污染进行治理 | |
| B. | 煤油可由石油分馏获得,可用作燃料和保存少量金属钠 | |
| C. | 工业上冶炼Al,使用Al2O3而不使用AlCl3,是因为AlCl3是共价化合物,熔融不导电 | |
| D. | 铜具有良好的导电性,常用来制作印刷电路板 |
| A. | N | B. | M | C. | Q | D. | K |
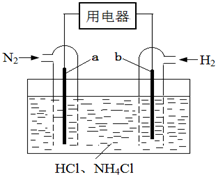 使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如图所示.下列有关分析正确的是( )
使用新型电极材料,以N2、H2为电极反应物,以HCl-NH4Cl为电解质溶液,可制造出一种既能提供电能,又能实现氮固定的新型燃料电池,原理如图所示.下列有关分析正确的是( )| A. | a为电池的负极 | |
| B. | 通入N2一极的电极反应式为:N2+6e-+8H+=2NH4+ | |
| C. | 电池工作一段时间后,溶液pH减小 |
| A. | 反应起始时,两容器中生成N2O4的速率关系是v(A)=v(B) | |
| B. | 反应达到平衡前,两容器中生成N2O4的速率关系是v(A)<v(B) | |
| C. | 反应达到平衡后,NO2的转化率大小关系是v(A)<v(B) | |
| D. | 两容器均达到平衡后,再分别充入等量的氮气,发生平衡移动的是B容器,且平衡移动后,NO2的转化率将增大 |
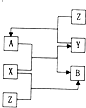 X、Y、Z为三种常见单质,Z为绿色植物光合作用后的产物之一,A、B为常见的化合物.它们在一定条件下可以发生如图所示的转化关系(反应均不是在溶液中进行的,反应条件已略去)(以下每空中填入一种即可)
X、Y、Z为三种常见单质,Z为绿色植物光合作用后的产物之一,A、B为常见的化合物.它们在一定条件下可以发生如图所示的转化关系(反应均不是在溶液中进行的,反应条件已略去)(以下每空中填入一种即可)