题目内容
(16分)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。2分
(2)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
① 此时溶液中c(SO32–)的浓度是0.2 mol·L-1,则溶液中c(HSO3–)是_______mol?L-1。
② 向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是 。2分
③ 某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示。则: ,有利于提高SO2的吸收效率。2分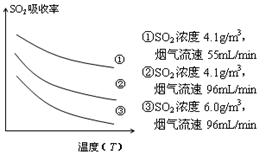
(3)工厂仓库存放的Na2SO3药品已部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定其含量,具体步骤如下:
步骤i 称取样品1.000 g。
步骤ii 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤iii 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01000 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
① 写出步骤iii所发生反应的离子方程式_________________________________;
② 在配制0.01000 mol·L-1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量________(填“偏大”、“偏小”或“无影响”)。
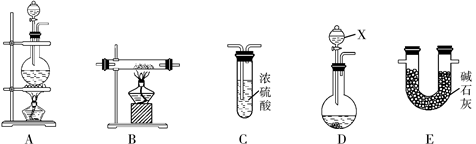
③ 某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是 (填字母)。

A B C D E
④ 滴定结果如下表所示:
| 滴定次数 | 待测溶液 的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
(1)SO2+H2O H2SO3;2H2SO3+O2=2H2SO4 (2分)
H2SO3;2H2SO3+O2=2H2SO4 (2分)
(或2SO2+O2  2SO3;SO3+H2O=H2SO4 或2SO2+O2+2H2O=2H2SO4)
2SO3;SO3+H2O=H2SO4 或2SO2+O2+2H2O=2H2SO4)
(2)① 1.6 (2分)
② 2NaHSO3+O2=Na2SO4+H2SO4 (2分)
③ 降低含硫烟气的温度(或减小含硫烟气的流速) (2分)
(3)① 2MnO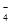 +5SO
+5SO +6H+=2Mn2++5SO
+6H+=2Mn2++5SO +3H2O (2分)
+3H2O (2分)
② 偏大 (2分) ③ AC (2分,漏选得1分,错选0分)
④ 63.00% 或63.0% (2分,写“63%”0分)
解析试题分析:(1)二氧化硫与水反应生成亚硫酸,亚硫酸与氧气反应生成硫酸形成酸雨,化学方程式为SO2+H2O H2SO3;2H2SO3+O2=2H2SO4
H2SO3;2H2SO3+O2=2H2SO4
(2)①根据钠元素守恒,可得2c(SO32–)+ c(HSO3–)=1.0mol/L×2,所以c(HSO3–)=2.0-0.4=1.6mol/L;
②亚硫酸氢钠与氧气发生氧化还原反应生成的两种物质只能是硫酸钠和硫酸,化学方程式为2NaHSO3+O2=Na2SO4+H2SO4 ;
③根据图示可知,温度升高,二氧化硫的吸收率降低;当烟气的流速是55mL/min时,相同温度下二氧化硫的吸收率最高,所以降低含硫烟气的温度(或减小含硫烟气的流速)可以提高二氧化硫的吸收效率;
(3)① 高锰酸钾与未被氧化的亚硫酸钠发生氧化还原反应生成锰离子和硫酸根离子、水,离子方程式为2MnO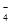 +5SO
+5SO +6H+=2Mn2++5SO
+6H+=2Mn2++5SO +3H2O ;
+3H2O ;
②配制0.01000 mol·L-1 KMnO4溶液时若仰视定容,灰使所配高锰酸钾溶液的浓度偏低,滴定时消耗的高锰酸钾溶液的体积偏大,造成测定Na2SO3的含量偏大;
③根据实验步骤,滴定时高锰酸钾溶液用酸式滴定管,待测液放在锥形瓶中,所以选择的仪器是A、C;
④三组数据中所用高锰酸钾溶液的体积平均是20.00mL,则高锰酸钾的物质的量是0.0200L×0.01000 mol·L-1,根据①的离子方程式可知25mL溶液中亚硫酸钠的物质的量是0.0200L×0.01000 mol·L-1×5/2=5×10-4mol,所以样品中Na2SO3的质量是5×10-4mol×10×126g/mol=0.63g,所以样品中Na2SO3的质量分数是0.63g/1.0g×100%=63.0%。
考点:考查酸雨的形成,守恒规律的应用,滴定实验的分析与计算,仪器的选择,化学方程式、离子方程式的书写

在一只试管中装入NO2和NO混合气体a升(常温常压,下同。不考虑NO2转化为N2O4。),倒扣在水槽中,与水充分反应后剩余气体b升(不含水蒸气),再通入c 升O2,试管内刚好无气体剩余。
(1)b的值为 (用只含c的代数式表示)。
(2)填表。
| 表达要求 | 只含b的代数式 | 只含c的代数式 |
| a的取值范围 | | |
(3)写出只含c的代数式的推导过程。
(22分)黄铁矿(FeS2)燃烧产生的SO2通过下列工艺过程既能制得H2SO4,又能制得H2。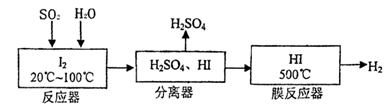
(1)该过程中能循环利用的物质为 。
(2)写出反应器中发生反应的离子方程式 。
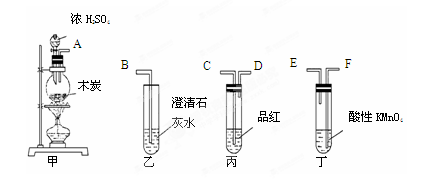
(3)某研究性学习小组欲探究SO2能否与BaCl2溶液反应生成BaSO3沉淀,进行如下实验。
已知浓硫酸的沸点为338oC,加热时酒精灯火焰的温度为400oC~500oC。
①甲同学用装置I(如下图)进行实验,发现BaCl2溶液中出现白色沉淀,且白色沉淀不溶于盐酸,该实验结论不能说明SO2能与BaCl2溶液发生反应,请解释生成该白色沉淀的两种可能原因(用文字和离子方程式表示):
,
;
②乙同学设计了装置Ⅱ(夹持装置和A的加热装置略去)进行实验,发现C中没有出现白色沉淀。
装置Ⅱ改进了装置I的四处不足,请填表说明另外的三处。
| 改进的操作或装置(注明必要的试剂) | 改进的作用 |
| 使用分液漏斗滴加浓硫酸 | 控制反应速率 |
| | |
| | |
| | |
a.NaOH溶液 b.H2O2溶液 C.新制氯水 d.酸性KMnO4溶液
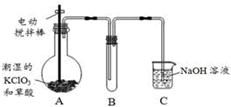
(16分)亚硝酸钠被称为工业盐,在漂白、电镀等方面应用广泛。以木炭、浓硝酸、水和铜为原料生成的一氧化氮与过氧化钠反应制备亚硝酸钠的装置如下图所示。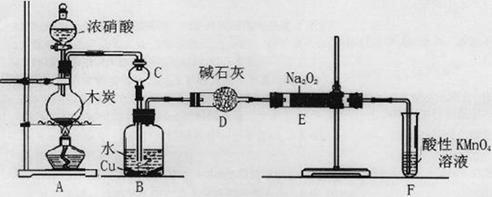
已知:室温下,① 2NO+Na2O2=2NaNO2;②酸性条件下,NO或NO2—都能与MnO4—反应生成NO3—和Mn2+,5NO2— + 2MnO4—+ 6H+=5NO3—+ 2Mn2++ 3H2O。
(1)A中观察到的现象__________________________。
(2)装置B中反应的离子方程式有____________________,_____________________。
(3)装置C的作用:____________________,装置F的作用:___________________。
(4)若无装置D,则E中产物除亚硝酸钠外还含有副产物________________________。(填化学式)
(5)NaNO2有像食盐一样的咸味,但能引起中毒。已知亚硝酸钠能发生如下反应:2NaNO2+4HI=2NO+I2+2NaI+2H2O,根据上述反应,可以用试剂和生活中常见的物质进行实验,以鉴别亚硝酸钠和食盐。进行实验时,必须选用的物质有__________________。
| A.自来水 | B.碘化钾淀粉试液 | C.淀粉 | D.白糖 E.食醋 F.白酒 |