题目内容
在一只试管中装入NO2和NO混合气体a升(常温常压,下同。不考虑NO2转化为N2O4。),倒扣在水槽中,与水充分反应后剩余气体b升(不含水蒸气),再通入c 升O2,试管内刚好无气体剩余。
(1)b的值为 (用只含c的代数式表示)。
(2)填表。
| 表达要求 | 只含b的代数式 | 只含c的代数式 |
| a的取值范围 | | |
(3)写出只含c的代数式的推导过程。
(1)4c/3或1.33c(2分)(带单位扣1分)
b<a<3b(2分)(若有取等号扣1分,后同); 4c/3<a<4c或1.33c<a<4c
(3)2分。(说理或推导充分即可。可用方程式推导;也可用得失电子守恒推导。)
解析试题分析:(1)NO2溶于水生成硝酸和NO,反应的方程式为3NO+H2O=2HNO3+NO,因此bL气体是NO。通入氧气后NO转化为稀硝酸,反应的方程式为
4NO+3O2+2H2O=4HNO3
4 3
b c
即4:3=b:c
解得b=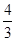 c
c
(2)如果混合气全部是NO2,则根据方程式3NO+H2O=2HNO3+NO可知生成NO的体积是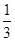 a,b=
a,b=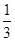 a;如果全部是NO,则生成b=a,所以
a;如果全部是NO,则生成b=a,所以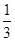 a<b<a,则a的取值范围是b<a<3b;根据(1)中计算可知,b=
a<b<a,则a的取值范围是b<a<3b;根据(1)中计算可知,b=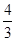 c,所以如果只用含c的代数式表示,则a的取值范围是
c,所以如果只用含c的代数式表示,则a的取值范围是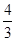 c<a<4c。
c<a<4c。
(3)如果混合气全部是NO2,反应中氮元素的化合价从+4价升高到+5价,氧气中氧元素的化合价从0价降低到-2价,则根据电子得失守恒可知a=4c;如果全部是NO,反应中氮元素的化合价从+2价升高到+5价,氧气中氧元素的化合价从0价降低到-2价,则根据电子得失守恒可知3a=4c,所以a的取值范围是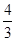 c<a<4c。
c<a<4c。
考点:考查NO2、NO与水以及氧气反应的有关计算

 名校课堂系列答案
名校课堂系列答案(16分)火力发电在我国的能源利用中占较大比重,但是排放出的SO2会造成一系列环境和生态问题,直接排放含SO2的烟气会形成酸雨,危害环境。
(1)用化学方程式表示SO2形成硫酸型酸雨的反应: 。2分
(2)工业上用Na2SO3溶液吸收烟气中的SO2。将烟气通入1.0 mol·L-1的Na2SO3溶液,溶液pH不断减小。当溶液pH约为6时,吸收SO2的能力显著下降,应更换吸收剂。
① 此时溶液中c(SO32–)的浓度是0.2 mol·L-1,则溶液中c(HSO3–)是_______mol?L-1。
② 向pH约为6的吸收剂中通入足量的O2,可将其中的NaHSO3转化为两种物质,反应的化学方程式是 。2分
③ 某研究小组为探究提高含硫烟气中SO2的吸收效率的措施,模拟实验吸收含硫烟气,实验结果如图所示。则: ,有利于提高SO2的吸收效率。2分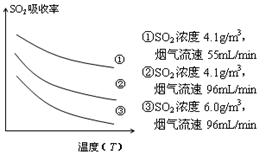
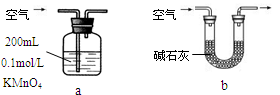
(3)工厂仓库存放的Na2SO3药品已部分被空气氧化,该化学小组想用已知浓度的酸性KMnO4溶液来确定其含量,具体步骤如下:
步骤i 称取样品1.000 g。
步骤ii 将样品溶解后,完全转移到250 mL容量瓶中,定容,充分摇匀。
步骤iii 移取25.00 mL样品溶液于250 mL锥形瓶中,用0.01000 mol·L-1 KMnO4标准溶液滴定至终点。
按上述操作方法再重复2次。
① 写出步骤iii所发生反应的离子方程式_________________________________;
② 在配制0.01000 mol·L-1 KMnO4溶液时若仰视定容,则最终测得药品中Na2SO3的含量________(填“偏大”、“偏小”或“无影响”)。
③ 某同学设计用下列仪器进行滴定实验(夹持部分略去),最合理的组合是 (填字母)。

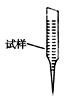
A B C D E
④ 滴定结果如下表所示:
| 滴定次数 | 待测溶液 的体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.02 | 21.03 |
| 2 | 25.00 | 2.00 | 21.99 |
| 3 | 25.00 | 2.20 | 20.20 |
 N2O3(g),其平衡常数表达式为K= 。
N2O3(g),其平衡常数表达式为K= 。