题目内容
16.某铝合金中含有铁、铝、镁、铜、硅.为了测定该合金中铝的含量,现设计了如下实验: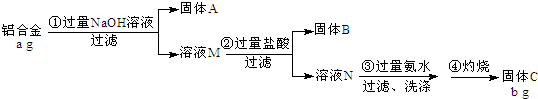
已知:Si+2NaOH+H2O=Na2SiO3+2H2↑,H2SiO3是不溶于水的弱酸.
(1)固体A的成分是:Fe、Mg、Cu,溶液M中的阴离子有:OH-、AlO2-、SiO32-
(2)步骤③中生成沉淀的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+
(3)该样品中铝的质量分数是:$\frac{9b}{17a}$×100%(用a、b表示).
(4)下列因操作不当,会使测定结果偏大的是CD
A.第①步中加入NaOH溶液不足
B.第②步中加入盐酸不足时
C.第③步中的沉淀未用蒸馏水洗涤
D.第④步对沉淀灼烧不充分.
分析 铝合金中含有铁、铝、镁、铜、硅,加入过量氢氧化钠溶液过滤,Al、Si反应溶解,固体A为Fe、Mg、Cu,溶液M含有NaAlO2,Na2SiO3及过量的NaOH,溶液M中加入过量盐酸反应过滤得到固体B为H2SiO3,溶液N中含有AlCl3、NaCl,再加入过量氨水过滤洗涤得到氢氧化铝沉淀,灼烧得到固体C为Al2O3;
(1)由上述分析可知,固体A为Fe、Mg、Cu,溶液M含有NaAlO2,Na2SiO3及过量的NaOH;
(2)步骤③是氯化铝和一水合氨反应生成氢氧化铝沉淀的反应与氯化铵;
(3)固体C为Al2O3,根据铝元素守恒计算合金中Al的质量,进而计算Al的质量分数;
(4)A.第①步中加入NaOH溶液不足,铝未全部溶解,测定结果偏低;
B.第②步中加入盐酸不足时,生成的偏铝酸钠未全部转化为氯化铝,导致最后生成的氧化铝质量减小;
C.第③步中沉淀未用蒸馏水洗涤,表面有杂质氯化钠、氯化铵,灼烧氯化铵分解,氯化钠会导致测定固体氧化铝的质量增大;
D.第④步对沉淀灼烧不充分,得到固体C质量增大.
解答 解:铝合金中含有铁、铝、镁、铜、硅,加入过量氢氧化钠溶液过滤,Al、Si反应溶解,固体A为Fe、Mg、Cu,溶液M含有NaAlO2,Na2SiO3及过量的NaOH,溶液M中加入过量盐酸反应过滤得到固体B为H2SiO3,溶液N中为AlCl3溶液,再加入过量氨水过滤洗涤得到氢氧化铝沉淀,灼烧得到固体C为Al2O3;
(1)由上述分析可知,固体A为Fe、Mg、Cu,溶液M含有NaAlO2,Na2SiO3及过量的NaOH,含有阴离子有:OH-、AlO2-、SiO32-,
故答案为:Fe、Mg、Cu;OH-、AlO2-、SiO32-;
(2)步骤③是氯化铝和一水合氨反应生成氢氧化铝沉淀的反应与氯化铵,反应离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
(3)bg固体C为Al2O3,根据铝元素守恒,铝的质量分数为:$\frac{bg×\frac{54}{102}}{ag}$×100%=$\frac{9b}{17a}$×100%,故答案为:$\frac{9b}{17a}$×100%;
(4)A.第①步中加入NaOH溶液不足,铝未全部溶解,测定结果偏低;
B.第②步中加入盐酸不足时,生成的偏铝酸钠未全部转化为氯化铝,导致最后生成的氧化铝质量减小,测定结果偏低;
C.第③步中沉淀未用蒸馏水洗涤,表面有杂质氯化钠、氯化铵,灼烧氯化铵分解,氯化钠会导致测定固体氧化铝的质量增大,测定结果偏高;
D.第④步对沉淀灼烧不充分,得到固体C质量增大,测定结果偏高,
故选:CD.
点评 本题考查物质组成含量的测定,明确工艺流程是解题关键,侧重考查学生对基础知识的迁移运用能力,难度中等.

| A. | 在甲苯中加入少量酸性高锰酸钾溶液,振荡后褪色,正确的解释是由于侧链与苯环的相互影响,使侧链和苯环均易被氧化 | |
| B. | 用核磁共振氢谱鉴别1-丙醇和2-丙醇 | |
| C. | 酸性高锰酸钾溶液和溴水都既能鉴别出甲烷和乙烯又能除去甲烷中含有的乙烯再经干燥而获得纯净的甲烷 | |
| D. | 辛烷、己烯和苯在工业上都可直接通过石油分馏得到 |
| A. | 向淀粉水解液中滴加碘水,检验淀粉是否已经水解 | |
| B. | 利用多次滴加Na2SO4溶液能够提纯蛋白质 | |
| C. | 加新制Cu(OH)2悬浊液加热,可检验糖尿病人尿液中的葡萄糖 | |
| D. | 除去甲苯中含有的少量苯酚,可加入NaOH溶液振荡后,静置分液 |

已知:25℃时,Ksp[Fe(OH)3]=2.79×10-39
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 |
| 开始沉淀(pH) | 2.3 | 7.5 | 7.6 | 3.4 |
| 完全沉淀(pH) | 4.1 | 9.7 | 9.2 | 5.2 |
②加入CoCO3调pH为5.2~7.6,则操作I获得的滤渣成分为Fe(OH)3、Al(OH)3.
③已知:Fe(OH)3(s)?Fe3+ (aq)+3OH-(aq)△H=akJ/mol
 H2O(l)═H+ (aq)+OH- (aq)△H=b kJ/mol
H2O(l)═H+ (aq)+OH- (aq)△H=b kJ/mol请写出Fe3+发生水解反应的热化学方程式:Fe3+(aq)+3H2O(l)?Fe(OH)3(s)+3H+ (aq)△H=(3b-a)kJ/mol.水解平衡常数Kh=$\frac{1{0}^{-3}}{2.79}$.
④加盐酸调整pH为2~3的目的为抑制CoCl2水解.
⑤操作Ⅱ过程为蒸发浓缩、冷却结晶(填操作名称)、过滤.
(2)某锂离子电池正极是LiCoO2,含Li+导电固体为电解质.充电时,Li+还原为Li,并以原子形式嵌入电池负极材料C6中(如图所示).电池反应为LiCoO2+C6$?_{放电}^{充电}$CoO2+LiC6,写出该电池放电时的正极反应式:CoO2+Li++e-=LiCoO2.

部分离子以氢氧化物形式开始沉淀和沉淀完全时的pH如下表:
| 离子 | Fe2+ | Fe3+ | Cu2+ |
| 开始沉淀时的pH(初始浓度为1.0mol/L) | 6.5 | 1.5 | 4.2 |
| 沉淀完全时的pH | 9.7 | 3.2 | 6.7 |
(1)常温下二价锌在水溶液中的存在形式与pH的关系如图,横坐标为溶液的pH,纵坐标为Zn2+或Zn(OH)42-(配离子)物质的量浓度的对数(假设Zn2+离子浓度为10-5mol•L-1时,Zn2+离子已沉淀完全).
利用图中数据计算,Ksp[Zn(OH)2]=1×10-17.
(2)写出试剂a、b的化学式:a:ZnO或Zn(OH)2;b:Zn.
(3)写出加入H2O2后发生反应的离子反应方程式:H2O2+2Fe2++2H+═2Fe3++2H2O.
(4)写出沉锌过程中的离子反应方程式:2Zn2++4HCO3-=Zn(OH)2•ZnCO3↓+3CO2↑+H2O,沉锌后溶液中主要溶质的化学式是(NH4)2SO4.
(5)将碱式碳酸锌加热分解可得到具有催化性能的活性氧化锌,可用于催化尿素与甲醇合成碳酸二甲酯(DMC)的反应.写出碱式碳酸锌受热分解的化学方程式Zn(OH)2•ZnCO3=2ZnO+CO2↑+H2O.
(6)利用氯化锌溶液与碳酸钠溶液反应制得的碳酸锌中混有碱式碳酸锌,某同学取一定质量的该固体,灼烧至恒重,能否通过固体质量的减少量来确定固体的成分?能 (填“能”或“否”)
| A. | 苯和苯酚 | B. | 甲烷和2,2-二甲基丁烷 | ||
| C. | 乙醇和乙二醇 | D. | 1,1-二氯乙烷和1,2-二氯乙烷 |
| Na2O | Na | AlF3 | AlCl3 | Al2O3 | BCl3 | CO2 | SiO2 |
| 920℃ | 97.8℃ | 1 291℃ | 190℃ | 2 073℃ | -107℃ | -57℃ | 1 723℃ |
| A. | 只要含有金属阳离子的晶体就一定是离子晶体 | |
| B. | 在共价化合物分子中各原子都形成8电子结构 | |
| C. | 金属晶体的熔点不一定比分子晶体的高 | |
| D. | 同族元素的氧化物不可能形成不同类型的晶体 |


