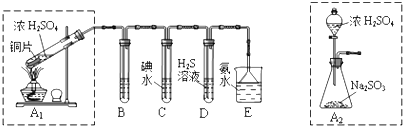
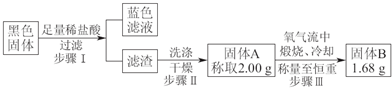
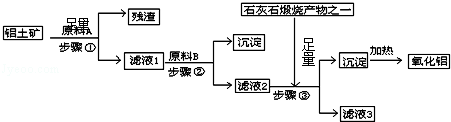
题目内容
10.下列关系的表述中,正确的是( )| A. | 已知草酸氢钾溶液呈酸性,则在amol•L-1 KHC2O4溶液中,c(C2O42-)<c(H2C2O4) | |
| B. | 新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-) | |
| C. | 0.2mol/LCH3COOH溶液与0.1mol/LNaOH溶液等体积混合:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH) | |
| D. | pH=3的盐酸和pH=3的FeCl3溶液中,水电离的c(H+)相等 |
分析 A.草酸氢钾溶液呈酸性,说明草酸氢根离子的电离程度大于其水解程度,则c(C2O42-)>c(H2C2O4);
B.根据混合液中的电荷守恒判断;
C.反应后溶质为等浓度的醋酸和醋酸钠,根据混合液中的物料守恒和电荷守恒判断;
D.盐酸中氢离子抑制了水的电离,溶液中氢氧根离子是水电离的,而氯化铁溶液中,铁离子促进了水的电离,溶液中氢离子是水电离的.
解答 解:A.KHC2O4溶液呈酸性,说明HC2O4-的电离程度大于其水解程度,则正确的浓度大小为:c(C2O42-)>c(H2C2O4),故A错误;
B.新制氯水中加入固体NaOH,根据电荷守恒可得:c(Na+)+c(H+)=c(Cl-)+c(ClO-)+c(OH-),故B错误;
C.设溶液体积都为1L,两者反应化学反应方程式为:CH3COOH+NaOH=CH3COONa+H2O,故反应生成醋酸钠物质的量为0.1mol,剩余醋酸物质的量为0.1mol,等体积混合后故c(CH3COOH)=$\frac{0.1mol}{2L}$=0.05mol/L,c(CH3COONa)=$\frac{0.1mol}{2L}$=0.05mol/L,根据物料守恒可得:c(CH3COOH)+c(CH3COO-)=2c(Na+),根据电荷守恒可得:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),二者结合可得:2c(H+)-2c(OH-)=c(CH3COO-)-c(CH3COOH),故C正确;
D.pH=3的盐酸中,氢离子抑制了水的电离,水电离的氢离子为溶液中的氢氧根离子;pH=3的FeCl3溶液中,铁离子水解促进了水的电离,溶液中氢离子是水电离的,所以了溶液中水电离的c(H+)浓度不相等,故D错误;
故选C.
点评 本题考查了离子浓度大小比较,题目难度中等,明确电荷守恒、物料守恒及盐的水解原理的含义为解答关键,D为易错点,注意酸碱溶液抑制了水的电离、能够水解的盐溶液促进了水的电离,试题培养了学生的分析能力及灵活应用基础知识的能力.

 高中必刷题系列答案
高中必刷题系列答案| A. | 纤维素、油脂、蛋白质均是天然高分子化合物 | |
| B. | 聚氯乙烯塑料制品可用于食品包装 | |
| C. | “地沟油”可以食用,也可以用来制肥皂 | |
| D. | 利用粮食酿酒经历了淀粉→葡萄糖→乙醇的化学变化过程 |
| A. | 向淀粉水解液中滴加碘水,检验淀粉是否已经水解 | |
| B. | 利用多次滴加Na2SO4溶液能够提纯蛋白质 | |
| C. | 加新制Cu(OH)2悬浊液加热,可检验糖尿病人尿液中的葡萄糖 | |
| D. | 除去甲苯中含有的少量苯酚,可加入NaOH溶液振荡后,静置分液 |
 一定温度下,向容积为2L的恒容密闭容器中充入6mol CO2和8mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得n(H2)随时间变化如曲线Ⅰ所示.下列说法正确的是( )
一定温度下,向容积为2L的恒容密闭容器中充入6mol CO2和8mol H2,发生反应:CO2(g)+3H2(g)?CH3OH(g)+H2O(g)△H=-49.0kJ•mol-1,测得n(H2)随时间变化如曲线Ⅰ所示.下列说法正确的是( )| A. | 该反应在0~8 min内CO2的平均反应速率是 0.375 mol•L-1•min-1 | |
| B. | 若起始时向上述容器中充入3 mol CO2和4 mol H2,则平衡时H2的体积分数大于20% | |
| C. | 若起始时向上述容器中充入4 mol CO2、2 mol H2、2 mol CH3OH和1mol H2O(g),则此时反应向正反应方向进行 | |
| D. | 改变条件得到曲线Ⅱ、Ⅲ,则曲线Ⅱ、Ⅲ改变的条件分别是升高温度、充入氦气 |
| A. | 电负性:X<Y | |
| B. | 周期表中,X可能在Y的右边 | |
| C. | 若X与Y形成化合物,则X显正价,Y显负价 | |
| D. | 气态氢化物的稳定性:HmY强于HnX |

 .
.