题目内容
4.判断下列离子方程式是否正确,正确的打“√”错误的打“×”,并写出正确的离子方程式.①钛粉溶于稀盐酸中:2Fe+6H+═2Fe3++3H2↑×,Fe+2H+═Fe2++H2↑
②用三氯化铝溶液和氨水制Al(OH)3沉淀:Al3++3H2O═Al(OH)3↓+3H+×,Al3++3NH3•H2O=Al(OH)3↓+3NH4+
③氢氧化铁溶于盐酸:OH-+H+═H2O×,Fe(OH)3+3H+=Fe3++3H2O
④氢氧化钡溶液与硫酸铜溶液混合:2OH-+Cu2+═Cu(OH)2↓×,SO42-+Ba2++Cu2++2OH-=Cu(OH)2↓+BaSO4↓
⑤二氧化硫气体通入氢氧化钠溶液中:SO2+2OH-═SO42-+H2O×,SO2+2OH-═SO32-+H2O.
分析 ①铁与盐酸反应生成氯化亚铁和氢气,不会生成铁离子;
②氨水为弱碱,一水合氨在离子方程式中应该保留分子式;
③氢氧化铁为难溶物,离子方程式中不能拆开;
④氢氧化钡与硫酸铜反应生成硫酸钡沉淀和氢氧化铜沉淀,漏掉了生成硫酸钡的反应;
⑤二氧化硫与氢氧化钠溶液反应生成亚硫酸钠和水.
解答 解:①铁与盐酸反应生成氯化亚铁和氢气,离子方程式为:Fe+2H+═Fe2++H2↑,故(1)错误;原因:不符合反应的客观事实;
故答案为:×,Fe+2H+═Fe2++H2↑;
②一水合氨为弱电解质,离子方程式中不能拆开,正确的离子方程式为:Al3++3NH3•H2O=Al(OH)3↓+3NH4+,
故答案为:×,Al3++3NH3•H2O=Al(OH)3↓+3NH4+;
③氢氧化铁不能拆开,正确的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O,
故答案为:×,Fe(OH)3+3H+=Fe3++3H2O;
④漏掉了钡离子与硫酸根离子的反应,正确的离子方程式为:SO42-+Ba2++Cu2++2OH-=Cu(OH)2↓+BaSO4↓,
故答案为:×,SO42-+Ba2++Cu2++2OH-=Cu(OH)2↓+BaSO4↓;
⑤氢氧化钠溶液与二氧化硫反应生成亚硫酸钠,不是生成硫酸钠,正确的离子方程式为:SO2+2OH-═SO32-+H2O,
故答案为:×,SO2+2OH-═SO32-+H2O.
点评 本题考查了离子方程式的正误判断,为中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)、检查是否符合原化学方程式等.

练习册系列答案
 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案
相关题目
7.下列化合物中,含有非极性键的离子化合物是( )
| A. | Ba(OH)2 | B. | H2O2 | C. | Na2O2 | D. | CaCl2 |
19.下列关于热化学反应的描述中正确的是( )
| A. | 一定条件下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-38.6 kJ•mol-1 | |||||||||||
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g);△H=+566.0kJ/mol
| |||||||||||
| C. | 已知则可以计算CH3-CH3(g)→CH2=CH2(g)+H2(g);△H=+125.6 kJ/mol | |||||||||||
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
9.某溶液中只含有K+、Fe3+、NO3-,已知K+、Fe3+的个数分别为3a和a,则溶液中K+与NO3-的个数比为( )
| A. | 1:4 | B. | 1:2 | C. | 3:4 | D. | 3:2 |
16.根据下列热化学方程式,判断氢化物的稳定性顺序正确的是( )
N2(g)+3H2 (g)=2NH3(g)△H=-92.38kJ•mol-1
H2(g)+Cl2(g)=2HCl(g)△H=-184.72kJ•mol-1
I2(g)+H2(g)=2HI(g)△H=+51.92kJ•mol-1.
N2(g)+3H2 (g)=2NH3(g)△H=-92.38kJ•mol-1
H2(g)+Cl2(g)=2HCl(g)△H=-184.72kJ•mol-1
I2(g)+H2(g)=2HI(g)△H=+51.92kJ•mol-1.
| A. | HI>HCl>NH3 | B. | HCl>NH3>HI | C. | HCl>HI>NH3 | D. | NH3>HI>HCl |
13.同一周期的X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性顺序为HXO4>H2YO4>H3ZO4,则下列判断错误的是( )
| A. | 原子半径:X>Y>Z | B. | 气态氢化物的稳定性:HX>H2Y>ZH3 | ||
| C. | 元素原子得电子能力:X>Y>Z | D. | 阴离子的还原性:Z3->Y2->X- |

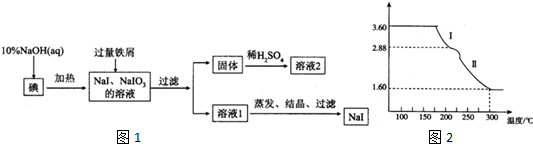
 已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气.
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气.