题目内容
13.同一周期的X、Y、Z三种元素,已知最高价氧化物对应水化物的酸性顺序为HXO4>H2YO4>H3ZO4,则下列判断错误的是( )| A. | 原子半径:X>Y>Z | B. | 气态氢化物的稳定性:HX>H2Y>ZH3 | ||
| C. | 元素原子得电子能力:X>Y>Z | D. | 阴离子的还原性:Z3->Y2->X- |
分析 非金属性越强,最高价氧化物对应水化物的酸性越强,最高价氧化物对应水化物的酸性是:HXO4>H2YO4>H3ZO4,则非金属性X>Y>Z,同周期自左而右,原子半径逐渐减小,元素非金属性增强,氢化物的稳定性逐渐增强,氢化物的还原性逐渐减弱.
解答 解:非金属性越强,最高价氧化物对应水化物的酸性越强,最高价氧化物对应水化物的酸性是:HXO4>H2YO4>H3ZO4,则非金属性X>Y>Z.
A.同周期元素的原子从左到右,非金属性增强,原子半径逐渐减小,所以原子半径:X<Y<Z,故A错误;
B.非金属性越强,氢化物越稳定,由于非金属性:X>Y>Z,所以气态氢化物的稳定性:HX>H2Y>ZH3,故B正确;
C.最高价氧化物对应水化物的酸性是:HXO4>H2YO4>H3ZO4,则非金属性X>Y>Z,即得电子能力:X>Y>Z,故C正确;
D.元素非金属性越强,阴离子的还原性越弱,由于非金属性X>Y>Z,所以阴离子的还原性:Z3->Y2->X-,故D正确.
故选A.
点评 本题考查元素周期律知识,题目难度不大,注意理解掌握同周期元素性质的递变规律.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
3.为研究铁及其化合物的性质,某探究小组进行如下实验:将一表面有铁锈(Fe2O3)的铁钉浸泡在稀硫酸中一段时间,取适量浸泡后的溶液滴入少量KSCN溶液,未见溶液呈血红色.请根据要求回答问题:
(1)甲同学认为:“将一表面有铁锈(Fe2O3)的铁钉浸泡在稀硫酸中一段时间”,体系中不仅铁锈、铁与稀硫酸发生了反应,同时还发生另一个反应.
①铁锈与稀硫酸反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
②“还发生另一个反应”对应的离子方程式应为Fe+2Fe3+=3Fe2+.
(2)现有下列仪器和试剂,若要通过实验验证甲同学的分析是否正确,你将设计怎样的实验方案?请将你设计的方案填入下列表格中.
仪器:试管、胶头滴管
试剂:氯水、稀硫酸、铁粉、硫氰酸钾溶液
(1)甲同学认为:“将一表面有铁锈(Fe2O3)的铁钉浸泡在稀硫酸中一段时间”,体系中不仅铁锈、铁与稀硫酸发生了反应,同时还发生另一个反应.
①铁锈与稀硫酸反应的化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O.
②“还发生另一个反应”对应的离子方程式应为Fe+2Fe3+=3Fe2+.
(2)现有下列仪器和试剂,若要通过实验验证甲同学的分析是否正确,你将设计怎样的实验方案?请将你设计的方案填入下列表格中.
仪器:试管、胶头滴管
试剂:氯水、稀硫酸、铁粉、硫氰酸钾溶液
| 实验操作 | 实验现象 | 实验结论 |
| 取适量铁钉与稀硫酸浸泡后的溶液于试管中,依次滴入适量的氯水和几滴KSCN溶液,振荡. | 溶液呈血红色 | 乙同学的观点正确 (填“正确”或“错误”). |
1.下列变化过程,属于放热过程的是( )
①液态水变成水蒸气; ②酸碱中和反应; ③浓H2SO4稀释;
④固体氢氧化钠溶于水; ⑤H2在Cl2中燃烧; ⑥弱酸电离;
⑦NH4Cl晶体与Ba(OH )2•8H2O混合搅拌.
①液态水变成水蒸气; ②酸碱中和反应; ③浓H2SO4稀释;
④固体氢氧化钠溶于水; ⑤H2在Cl2中燃烧; ⑥弱酸电离;
⑦NH4Cl晶体与Ba(OH )2•8H2O混合搅拌.
| A. | ①③⑤ | B. | ①⑥⑦ | C. | ②④⑦ | D. | ②③④⑤ |
8.16O和18O是氧元素的两种核素,NA表示阿伏加德罗常数,下列说法正确的( )
| A. | 16O2与18O2互为同位素 | |
| B. | 16O与18O核外电子排布方式相同 | |
| C. | 通过化学变化可以实现16O与18O间的相互转化 | |
| D. | 1.12 L 16O2和1.12 L 18O2均含0.1NA个氧原子 |
18.下列各组物质之间的反应,反应产物一定为纯净物的是( )
| A. | 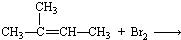 | B. | 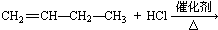 | ||
| C. | 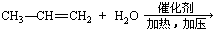 | D. | 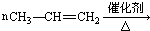 |
5.低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O(g)△H<0 在恒容的密闭容器中,下列有关说法正确的是( )
| A. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 | |
| B. | 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 | |
| C. | 平衡时,2v正(NO)=v逆(N2) | |
| D. | 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
2.下列关于热化学反应的描述中正确的是( )
| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ/mol | |
| B. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2 (g)△H=-192.9 kJ/mol,则CH3OH(g)的燃烧热△H=-192.9 kJ/mol | |
| C. | H2(g)的燃烧热△H=-285.8 kJ/mol,则2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ/mol | |
| D. | 葡萄糖的燃烧热△H=-2800 kJ/mol,则 $\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1400 kJ/mol |
3.砹(At)是原子序数最大的卤族元素,对砹及其化合物的叙述,正确的是( )
| A. | 与H2化合的能力:At2>I2 | B. | 砹在常温下为白色固体 | ||
| C. | 砹原子的最外层有7个电子 | D. | 砹易溶于水,难溶于四氯化碳 |