题目内容
19.下列关于热化学反应的描述中正确的是( )| A. | 一定条件下,将0.5 mol N2和1.5 mol H2置于密闭容器中充分反应生成NH3放热19.3kJ,其热化学方程式为:N2(g)+3H2(g)=2NH3(g)△H=-38.6 kJ•mol-1 | |||||||||||
| B. | CO(g)的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g);△H=+566.0kJ/mol
| |||||||||||
| C. | 已知则可以计算CH3-CH3(g)→CH2=CH2(g)+H2(g);△H=+125.6 kJ/mol | |||||||||||
| D. | 同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H不同 |
分析 A.0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol,相同条件下的同一可逆反应,热数值与化学计量数成正比;
B.燃烧热是1mol可燃物完全燃烧生成稳定氧化物放出的热量,利用燃烧热进行计算,反应方向改变,焓变符号改变;
C.根据反应热等于反应物总键能减生成物总键能计算;
D.反应的热效应只与始态、终态有关,与过程无关.
解答 解:A.相同条件下的同一可逆反应,热数值与化学计量数成正比,0.5molN2和1.5molH2置于密闭容器中充分反应生成NH3(g),放热19.3kJ,生成的氨气的物质的量小于1mol,所以生成2mol氨气分解,放出的热量大于38.6kJ,故A错误;
B.因CO(g)的燃烧热是283.0KJ/mol,则2CO(g)+O2(g)=2CO2(g)反应的△H=-2×283.0KJ/mol,则2CO2(g)=2CO(g)+O2(g)反应的△H=2×283.0KJ/mol=+566.0kJ/mol,故B正确;
C.在反应CH3-CH3→CH2=CH2+H2中,断裂6mol C-H键,1mol C-C键共吸收的能量为:6×414.4kJ+347.4kJ=2833.8kJ,
生成1molCH2=CH2和1molH2,共形成4molC-H键,1molC=C、1molH-H,共放出的能量为:4×414.4kJ+615.3kJ+435.3kJ=2708.2kJ,
吸收的能量多,放出的能量少,该反应为吸热反应,吸收的热量为:2833.8kJ-2708.2kJ=125.6,所以反应热为+125.6kJ/mol,
则热化学方程式为CH3-CH3(g)→CH2=CH2(g)+H2(g)△H=+125.6 kJ/mol,故C正确;
D.反应的热效应只与始态、终态有关,与过程无关,所以同温同压下,H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的△H相同,故D错误;
故选BC.
点评 本题考查了反应热的计算等,为高考常见题型,侧重于学生的分析能力和计算能力的考查,注意燃烧热的定义,注意根据反应热等于反应物总键能减生成物总键能计算反应热,题目难度不大.

 名校课堂系列答案
名校课堂系列答案| A. | 中和热测定实验中,缓慢地将NaOH溶液倒入测定装置中--测定结果无影响 | |
| B. | 酸碱中和滴定实验中,滴定前无气泡而滴定后有气泡_测定结果偏高 | |
| C. | 测定溶液pH的实验中,用干燥pH试纸测定新制氯水的pH--测定结果无影响 | |
| D. | 现需90mL 1.0mol•L-1NaOH溶液,称取3.6gNaOH固体配制--溶液浓度偏低 |
| A. | 18 | B. | 16 | C. | 8 | D. | 6 |
| A. | 16O2与18O2互为同位素 | |
| B. | 16O与18O核外电子排布方式相同 | |
| C. | 通过化学变化可以实现16O与18O间的相互转化 | |
| D. | 1.12 L 16O2和1.12 L 18O2均含0.1NA个氧原子 |
 、④HCHO,其中碳原子采取sp2杂化的分子有①③④
、④HCHO,其中碳原子采取sp2杂化的分子有①③④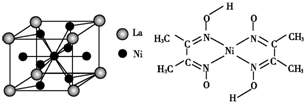

 随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.
随着我国工业化水平的不断发展,解决水、空气污染问题成为重要课题.