题目内容
14.实验室模拟合成氨和氨催化氧化的流程如下: 已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气.
已知实验室可用饱和亚硝酸钠(NaNO2)溶液与饱和氯化铵溶液经加热后反应制取氮气.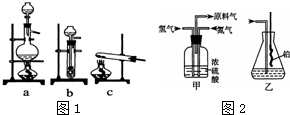
(1)从图1中选择制取气体的合适装置:氮气a.
(2)氮气和氢气通过甲装置,甲装置的作用有干燥气体、使气体混合均匀、控制氢气和氮气的流速.
(3)氨合成器出来经冷却的气体连续通入乙装置的水中吸收氨,不会(“会”或“不会”)发生倒吸,原因是:因为混合气体中含有大量难溶于水的氮、氢两种气体.
(4)用如图2乙装置吸收一段时间氨后,再通入空气,同时将经加热的铂丝插入乙装置的锥形瓶内,能使铂丝保持红热的原因是:说明氨的氧化反应是一个放热反应,锥形瓶中还可观察到的现象是:有红棕色气体产生、产生白烟.用化学方程式解释现象产生的原因2NO+O2=2NO23NO2+H2O=2HNO3+NONH3+HNO3=NH4NO3.
分析 (1)根据反应物的状态与反应条件选择发生装置;
(2)甲装置的作用有将气体混合均匀、控制氢气和氮气的流速、干燥气体;
(3)合成氨的反应是可逆的,还会有一些氮气、氢气存在,据此来回答;
(4)氨的氧化反应是一个放热反应;生成的一氧化氮与空气中的氧气化合成二氧化氮,二氧化氮与水反应生成硝酸,硝酸与氨气反应生成白色固体硝酸铵.
解答 解:(1)制备氨气的反应原理:NaNO2+NH4Cl$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2H20+NaCl,该反应为溶液加热制备气体,发生装置选择a;
故选:a;
(2)甲装置的作用有将气体混合均匀、控制氢气和氮气的流速、干燥气体;
故答案为:将气体混合均匀、控制氢气和氮气的流速;
(3)合成氨的反应为:N2+3H2$?_{催化剂}^{高温高压}$2NH3,该反应为可逆反应,还会有一些氮气、氢气存在,这样会缓解氨气极易溶于水导致的气压差,不会倒吸,
故答案为:不会;因为混合气体中含有大量难溶于水的氮气、氢气两种气体;
(4)氨的氧化反应是一个放热反应,放出的热使铂丝保持红热,锥形瓶中生成的一氧化氮与空气中的氧气化合成二氧化氮,方程式为:2NO+O2=2NO2,二氧化氮为红棕色气体,二氧化氮与水反应生成硝酸,方程式:3NO2+H2O=2HNO3+NO,硝酸与氨气反应生成白色固体硝酸铵,方程式:NH3+HNO3=NH4NO3;
故答案为:说明氨的氧化反应是一个放热反应;有红棕色气体产生;2NO+O2=2NO2 3NO2+H2O=2HNO3+NO NH3+HNO3=NH4NO3.
点评 本题考查了气体的制备原理和性质,明确氮及其化合物的性质是解题关键,题目难度不大.

练习册系列答案
 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案 快乐暑假暑假能力自测中西书局系列答案
快乐暑假暑假能力自测中西书局系列答案
相关题目
5.低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)?2N2(g)+3H2O(g)△H<0 在恒容的密闭容器中,下列有关说法正确的是( )
| A. | 平衡时,其他条件不变,升高温度可使该反应的平衡常数增大 | |
| B. | 平衡时,其他条件不变,增加NH3的浓度,废气中氮氧化物的转化率减小 | |
| C. | 平衡时,2v正(NO)=v逆(N2) | |
| D. | 其他条件不变,使用高效催化剂,废气中氮氧化物的转化率增大 |
2.下列关于热化学反应的描述中正确的是( )
| A. | 已知H+(aq)+OH-(aq)═H2O(l)△H=-57.3 kJ/mol,则H2SO4和Ba(OH)2反应的反应热△H=2×(-57.3)kJ/mol | |
| B. | 燃料电池中将甲醇蒸气转化为氢气的热化学方程式是CH3OH(g)+$\frac{1}{2}$O2(g)═CO2(g)+2H2 (g)△H=-192.9 kJ/mol,则CH3OH(g)的燃烧热△H=-192.9 kJ/mol | |
| C. | H2(g)的燃烧热△H=-285.8 kJ/mol,则2H2O(g)═2H2(g)+O2(g)△H=+571.6 kJ/mol | |
| D. | 葡萄糖的燃烧热△H=-2800 kJ/mol,则 $\frac{1}{2}$C6H12O6(s)+3O2(g)═3CO2(g)+3H2O(l)△H=-1400 kJ/mol |
9.a mol FeS与b mol FeO投入到V L、c mol•L-1的硝酸溶液中充分反应,产生NO气体,所得澄清溶液成分可看做是Fe(NO3)3、H2SO4的混合液,则反应中未被还原的硝酸可能为( )
①(a+b)×63g ②(a+b)×189g ③3(a+b) mol ④(Vc-$\frac{9a+b}{3}$)mol.
①(a+b)×63g ②(a+b)×189g ③3(a+b) mol ④(Vc-$\frac{9a+b}{3}$)mol.
| A. | ②④ | B. | ②③④ | C. | ②③ | D. | ①②③④ |
19.将2.0mol SO2气体和2.0mol SO3气体混合于固定体积的密闭容器中,在一定条件下发生反应:2SO2(g)+O2(g)?2SO3(g),达到平衡时SO3为n mol.在相同温度下,分别按下列配比在相同密闭容器中放入起始物质,平衡时SO3等于n mol的是( )
| A. | 1.6 mol SO2+0.3 mol O2+0.4 mol SO3 | |
| B. | 4.0 mol SO2+1.0 mol O2 | |
| C. | 2.0 mol SO2+1.0 mol O2+2.0 mol SO3 | |
| D. | 3.0 mol SO2+1.0 mol O2+1.0 mol SO3 |
6.使1mol乙烯与氯气发生完全加成反应,然后使该加成反应的产物与氯气在光照的条件下发生完全取代反应,则两个过程中消耗的氯气的总的物质的量是( )
| A. | 5mol | B. | 4.5mol | C. | 5.5mol | D. | 6mol |
3.砹(At)是原子序数最大的卤族元素,对砹及其化合物的叙述,正确的是( )
| A. | 与H2化合的能力:At2>I2 | B. | 砹在常温下为白色固体 | ||
| C. | 砹原子的最外层有7个电子 | D. | 砹易溶于水,难溶于四氯化碳 |