题目内容
13.学习小组设计了如图实验(部分装置),将氯气依次通过下列装置以验证氯气的性质: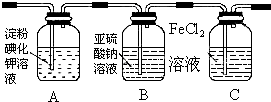
(1)通入氯气后,A中的现象是溶液变蓝色,C装置中发生的离子方程式为2Fe2++Cl2═2Fe3++2Cl-;
(2)通入氯气一段时间后,洗气瓶B溶液中有一部分SO32-氧化成SO42-.设计试验方案,检验洗气瓶B溶液中Cl-和SO42-的存在.填写出实验步骤、预期现象和结论.(可填满也可不填满)
限选试剂及仪器:2mol/L HCl、2mol/L HNO3、1mol/L BaCl2溶液、l mol/L Ba(NO3)2溶液、0.1mol/L AgNO3溶液、澄清石灰水、试管、胶头滴管.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取适量洗气瓶B中溶液于试管A中,滴加过量2 mol/LHCl和1 mol/LBaCl2溶液,振荡. | 若产生的白色沉淀,则洗气瓶B溶液中存在SO42-. |
| 步骤2:另取适量洗气瓶B中溶液于试管B中,滴加过量l mol/LBa(NO3)2溶液,振荡,静置. | 产生白色沉淀. |
| 步骤3:取步骤2后试管B中的上层清液于试管C中,滴加0.1mol/LAgNO3溶液和过量的2mol/LHNO3,振荡. | 若产生白色沉淀,则洗气瓶B溶液中存在Cl- |
分析 (1)氯气有氧化性,能和碘化钾反应生成碘单质,能与氯化亚铁反应生成氯化铁;
(2)步骤1:除去亚硫酸根离子,检验硫酸根离子,步骤2:除去亚硫酸根离子和硫酸根离子,步骤3:检验氯离子;
解答 解:(1)氯气有氧化性,能和碘化钾反应生成碘单质,碘遇淀粉变蓝色.能与氯化亚铁反应生成氯化铁,离子方程式为:2Fe2++Cl2═2Fe3++2Cl-,
故答案为:溶液变蓝色;2Fe2++Cl2═2Fe3++2Cl-;
(2)步骤1:除去亚硫酸根离子,可用过量2 mol/LHCl,检验硫酸根离子,可用1 mol/LBaCl2溶液,若产生的白色沉淀,则洗气瓶B溶液中存在SO42-,
故答案为:过量2 mol/LHCl和1 mol/LBaCl2溶液,振荡;
步骤2:除去亚硫酸根离子和硫酸根离子,可用过量1 mol/LBaCl2溶液,
故答案为:过量l mol/LBa(NO3)2溶液,振荡,静置;
步骤3:检验氯离子,可用0.1mol/LAgNO3溶液和过量的2mol/LHNO3,若产生白色沉淀,则洗气瓶B溶液中存在Cl-,
故答案为:0.1mol/LAgNO3溶液和过量的2mol/LHNO3,振荡;若产生白色沉淀,则洗气瓶B溶液中存在Cl-;
点评 本题考查了氯气的性质、氯离子和硫酸根离子的检验,难度中等.要注意掌握常见阴离子的检验方法和操作步骤.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
3.下列各组物质中,互为同素异形体的是( )
| A. | 红磷与白磷 | B. | 甲烷与乙烷 | C. | ${\;}_{1}^{1}$H与${\;}_{1}^{2}$H | D. | 正丁烷与异丁烷 |
4.金属铜的提炼多从黄铜矿开始.黄铜矿的焙烧过程中主要反应之一的化学方程式为:2CuFeS2+O2═□+2FeS+SO2,下列说法不正确的是( )
| A. | 方框中的物质应为 Cu2S | |
| B. | 若有1 molSO2生成,则反应中有4 mol 电子转移 | |
| C. | SO2既是氧化产物又是还原产物 | |
| D. | O2只作氧化剂 |
18.某“84消毒液”的包装说明如下:
下列说法不正确的是( )
| 主要成分:25% NaClO、1000mL、密度1.198g•cm-3 使用方法:稀释100倍(体积比)后使用 注意事项:密封保存,易吸收空气中CO2的变质 |
| A. | 该“84消毒液”的浓度为4.0mol•L-1 | |
| B. | 一瓶该“84消毒液”可能吸收CO2 44.8L(标况) | |
| C. | 稀释后的“84消毒液”中c(Na+)约为0.04 mol•L-1 | |
| D. | 若用NaClO 固体配制480mL含25%NaClO“84消毒液”,需要称量NaClO固体143g |
3.今有氢、氧、氮、钠、钙、氟、氯、铜8种元素.
(1)铜位于周期表 周期第四周期ⅠB族.
(2)用“>”、“<”填写下表
(3)已知下列共价键键能数据:
写出氧气与氯化氢气体反应生成氯气和气态水的热化学方程式:O2(g)+4HCl(g)=2Cl2(g)+2H2O(g)△H=-116KJ/mol.
(4)铜能与浓盐酸缓慢发生置换反应,有配合物H[CuCl2]生成.
①该反应的化学方程式为2Cu+4HCl(浓)=2H[CuCl2]+H2↑.
②H[CuCl2]在空气中久置会生成含[Cu(H2O)4]2+的蓝色溶液,[Cu(H2O)4]2+的结构可用示意图表示为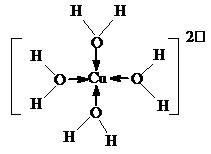 .
.
(1)铜位于周期表 周期第四周期ⅠB族.
(2)用“>”、“<”填写下表
| 第一电离能 | 电负性 | 晶格能 | 沸点 |
| O<N | Cl<F | NaCl<CaO | HF>HCl |
| 共价键 | H-Cl | O=O | H-O | Cl-Cl |
| 键能/kJ•mol-1 | 431 | 498 | 463 | 243 |
(4)铜能与浓盐酸缓慢发生置换反应,有配合物H[CuCl2]生成.
①该反应的化学方程式为2Cu+4HCl(浓)=2H[CuCl2]+H2↑.
②H[CuCl2]在空气中久置会生成含[Cu(H2O)4]2+的蓝色溶液,[Cu(H2O)4]2+的结构可用示意图表示为
 .
.
4.工业上生产硫酸时,利用催化氧化反应将二氧化硫转化为三氧化硫是一个关键步骤,在密闭容器中压强及温度对SO2转化率(利用率)的影响如表:
(1)写出二氧化硫转化为三氧化硫的化学方程式2SO2+O2?2SO3. 根据表中数据可知,生成 SO3 的反应属于放热反应(填“放热”或“吸热”. )
(2)在其他条件不变的情况下,扩大容器体积以减小反应体系的压强,v正减小 (填“增大”或“减小”,下同),v逆减小,平衡向逆反应方向移动(选填“正反应”或“逆反应”).
(3)若容器容积为2L,开始加入SO2为0.20mol,10s后测得SO2 的物质的量为0.16mol,则O2的平均反应速率为0.001mol(L•S);若即系通入氧气,则平衡时的SO2转化率增大(选填“增大”或“减小”)
(4)在 400℃~500℃时,SO2 的催化氧化采用常压而不是高压,其主要原因是常压时的转化率较高、高压成本高.
| 转化率(%) | 0.1MPa | 0.5MPa | 1.0MPa | 10MPa |
| 400℃ | 99.2% | 99.6% | 99.7% | 99.9% |
| 500℃ | 93.5% | 96.9% | 97.8% | 99.3% |
| 600℃ | 73.7% | 85.8% | 89.5% | 96.4% |
(2)在其他条件不变的情况下,扩大容器体积以减小反应体系的压强,v正减小 (填“增大”或“减小”,下同),v逆减小,平衡向逆反应方向移动(选填“正反应”或“逆反应”).
(3)若容器容积为2L,开始加入SO2为0.20mol,10s后测得SO2 的物质的量为0.16mol,则O2的平均反应速率为0.001mol(L•S);若即系通入氧气,则平衡时的SO2转化率增大(选填“增大”或“减小”)
(4)在 400℃~500℃时,SO2 的催化氧化采用常压而不是高压,其主要原因是常压时的转化率较高、高压成本高.
