题目内容
18.下列有关说法正确的是( )| A. | 常见铅蓄电池放电时,负极质量减轻,正极质量增加 | |
| B. | 电解法精炼铜时,以粗铜作阴极,纯铜作阳极 | |
| C. | 常温下,pH=5的盐酸稀释1000倍后,溶液的pH=8 | |
| D. | 水的离子积随温度升高而增大,说明水的电离是吸热反应 |
分析 A.铅蓄电池放电时,负极反应为:Pb-2e-+SO42-=PbSO4,正极的反应为:PbO2+2e-+4H++SO42-=PbSO4+2H2O;
B.电解精炼粗铜时,粗铜作阳极、纯铜作阴极;
C.酸无论如何稀释都不能变为中性或碱性;
D.水的离子积随温度升高而增大,说明升高温度促进水电离.
解答 解:A.铅蓄电池放电时,负极反应为:Pb-2e-+SO42-=PbSO4,正极的反应为:PbO2+2e-+4H++SO42-=PbSO4+2H2O,所以正负极质量都增大,故A错误;
B.电解精炼粗铜时,粗铜作阳极、纯铜作阴极,电解质溶液为可溶性铜盐溶液,故B错误;
C.酸无论如何稀释都不能变为中性或碱性,接近中性时要考虑水的电离,所以常温下,pH=5的盐酸稀释1000倍后,溶液的pH接近7但小于7,故C错误;
D.水的离子积随温度升高而增大,说明升高温度促进水电离,则水的电离是吸热反应,故D正确;
故选D.
点评 本题考查原电池和电解池原理及水的电离等知识点,侧重考查基本原理,明确原电池和电解池各个电极上发生的反应及水电离特点即可解答,易错选项是C,注意:酸或碱在稀释过程中接近中性时要考虑水的电离,为易错题.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
7.下列各组物质,在常温下不发生反应的是( )
①硫化氢和二氧化硫 ②铝与氧化铁 ③铜与稀硝酸 ④石英与纯碱
⑤一氧化氮与氧气 ⑥硅与氧气.
①硫化氢和二氧化硫 ②铝与氧化铁 ③铜与稀硝酸 ④石英与纯碱
⑤一氧化氮与氧气 ⑥硅与氧气.
| A. | ②③⑤ | B. | ②④⑥ | C. | ①②⑥ | D. | ①③⑤ |
13.已知下表所示数据:
(Ⅰ)某学生实验室制取乙酸乙酯的主要步骤如下:
①在30mL的大试管A中按体积比2:3:3配制浓硫酸、乙醇和乙酸的混合溶液.
②按图1连接好装置(装置气密性良好),用小火均匀加热装有混合液的大试管5~10min.
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置.
请根据题目要求回答下列问题:
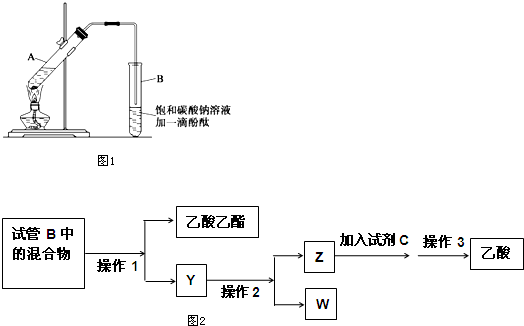
(1)配制该混合液时,滴加药品的顺序是乙醇,浓硫酸、乙酸(乙醇和浓硫酸的加入顺序不可互换).
(2)浓硫酸的主要作用是催化剂、脱水剂.
(3)导管不能插入到Na2CO3溶液中的原因是防止倒吸.
(4)做此实验时,有时还向A试管里加入几块碎瓷片,其目的是防止暴沸.
(5)指出步骤③所观察到的现象:液体分层,上层有无色油状液体,下层液体红色变浅.
(Ⅱ)实验完成后,图2是对图1试管B中收集到的混合物进行分离操作步骤流程图:
请回答:
(6)操作1,操作2,操作3所对应的操作名称为分液、蒸馏、蒸馏.
(7)得到的物质W中的官能团名称为羟基.
(8)试剂C可以选用下列的A(填序号).
A.H2SO4 B.CO2 C.NaOH D.NaCl.
| 物质 | 熔点(℃) | 沸点(℃) | 密度(g•cm-3) |
| 乙醇 | -117.3 | 78.5 | 0.79 |
| 乙酸 | 16.6 | 117.9 | 1.05 |
| 乙酸乙酯 | -83.6 | 77.5 | 0.90 |
| 浓硫酸 | 338.0 | 1.84 |
①在30mL的大试管A中按体积比2:3:3配制浓硫酸、乙醇和乙酸的混合溶液.
②按图1连接好装置(装置气密性良好),用小火均匀加热装有混合液的大试管5~10min.
③待试管B收集到一定量产物后停止加热,撤出试管B并用力振荡,然后静置.
请根据题目要求回答下列问题:

(1)配制该混合液时,滴加药品的顺序是乙醇,浓硫酸、乙酸(乙醇和浓硫酸的加入顺序不可互换).
(2)浓硫酸的主要作用是催化剂、脱水剂.
(3)导管不能插入到Na2CO3溶液中的原因是防止倒吸.
(4)做此实验时,有时还向A试管里加入几块碎瓷片,其目的是防止暴沸.
(5)指出步骤③所观察到的现象:液体分层,上层有无色油状液体,下层液体红色变浅.
(Ⅱ)实验完成后,图2是对图1试管B中收集到的混合物进行分离操作步骤流程图:
请回答:
(6)操作1,操作2,操作3所对应的操作名称为分液、蒸馏、蒸馏.
(7)得到的物质W中的官能团名称为羟基.
(8)试剂C可以选用下列的A(填序号).
A.H2SO4 B.CO2 C.NaOH D.NaCl.
3.今有氢、氧、氮、钠、钙、氟、氯、铜8种元素.
(1)铜位于周期表 周期第四周期ⅠB族.
(2)用“>”、“<”填写下表
(3)已知下列共价键键能数据:
写出氧气与氯化氢气体反应生成氯气和气态水的热化学方程式:O2(g)+4HCl(g)=2Cl2(g)+2H2O(g)△H=-116KJ/mol.
(4)铜能与浓盐酸缓慢发生置换反应,有配合物H[CuCl2]生成.
①该反应的化学方程式为2Cu+4HCl(浓)=2H[CuCl2]+H2↑.
②H[CuCl2]在空气中久置会生成含[Cu(H2O)4]2+的蓝色溶液,[Cu(H2O)4]2+的结构可用示意图表示为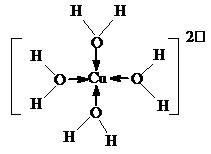 .
.
(1)铜位于周期表 周期第四周期ⅠB族.
(2)用“>”、“<”填写下表
| 第一电离能 | 电负性 | 晶格能 | 沸点 |
| O<N | Cl<F | NaCl<CaO | HF>HCl |
| 共价键 | H-Cl | O=O | H-O | Cl-Cl |
| 键能/kJ•mol-1 | 431 | 498 | 463 | 243 |
(4)铜能与浓盐酸缓慢发生置换反应,有配合物H[CuCl2]生成.
①该反应的化学方程式为2Cu+4HCl(浓)=2H[CuCl2]+H2↑.
②H[CuCl2]在空气中久置会生成含[Cu(H2O)4]2+的蓝色溶液,[Cu(H2O)4]2+的结构可用示意图表示为
 .
.
10.下列关于有机物的说法正确的是( )
| A. | 纯净物C4H8的核磁共振氢谱峰最多为4 | |
| B. | 化学式为C8H8的有机物,一定能使酸性高锰酸钾溶液褪色 | |
| C. | 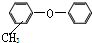 的同分异构体中,可以有醇、酚类物质 的同分异构体中,可以有醇、酚类物质 | |
| D. | 1 mol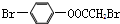 最多能与2 mol NaOH反应 最多能与2 mol NaOH反应 |
7.下列关于苯的叙述正确的是( )
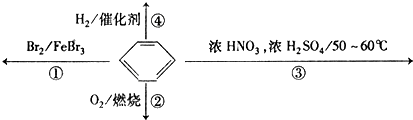

| A. | 反应①为取代反应,有机产物的密度比水小 | |
| B. | 反应②为氧化反应,反应现象是火焰明亮并带有较多的黑烟 | |
| C. | 反应③为取代反应,有机产物是一种烃 | |
| D. | 反应④1mol苯最多与3molH2发生加成反应,是因为苯分子含有三个碳酸双键 |

 ;
;