题目内容
17.对于NaHCO3与Na2CO3的性质,下列叙述错误的是( )| A. | 质量相同时,跟足量的盐酸反应,在相同条件下Na2CO3产生的CO2气体多 | |
| B. | 物质的量相同时,跟足量的盐酸反应,Na2CO3所消耗H+的物质的量是NaHCO3的2倍 | |
| C. | 物质的量相同时,跟足量的盐酸反应,在相同条件下得到等体积的CO2 | |
| D. | 将它们分别加入到澄清石灰水中,都产生白色沉淀 |
分析 A.依据碳酸钠、碳酸氢钠与盐酸反应生成二氧化碳量的关系式解答;
B.依据离子方程式:CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑判断解答;
C.1mol碳酸钠、碳酸氢钠,都含有1mol碳原子,依据碳原子个数守恒解答;
D.碳酸钠与氢氧化钙反应生成碳酸钙和氢氧化钠,碳酸氢钠与氢氧化钙反应生成碳酸钙和碳酸钠和水.
解答 解:A.1mol碳酸钠、碳酸氢钠都能生成1mol二氧化碳,等质量的Na2CO3和NaHCO3,NaHCO3物质的量较多,所以碳酸氢钠产生二氧化碳多,故A错误;
B.由CO32-+2H+═CO2↑+H2O,HCO3-+H+═H2O+CO2↑可知,Na2CO3所消耗H+的物质的量是NaHCO3的2倍,故B正确;
C.1mol碳酸钠、碳酸氢钠,都含有1mol碳原子,依据碳原子个数守恒,相同物质的量的二者与足量盐酸反应生成二氧化碳的物质的量相同,故C正确;
D.碳酸钠与氢氧化钙反应生成碳酸钙和氢氧化钠,碳酸氢钠与氢氧化钙反应生成碳酸钙和碳酸钠和水,二者都会产生碳酸钙沉淀,故D正确;
故选:A.
点评 本题考查了碳酸盐性质,熟悉碳酸钠、碳酸氢钠化学性质是解题关键,题目难度不大.

练习册系列答案
 挑战100单元检测试卷系列答案
挑战100单元检测试卷系列答案
相关题目
7.在 2L密闭容器中发生反应N2+3H2?2NH3,经一段时间后NH3 的物质的量增加了2.4mol,这段时间内用氢气表示的反应速率为0.6mol/(L•s),则这段时间为( )
| A. | 6 s | B. | 4 s | C. | 3 s | D. | 2 s |
8.已知短周期元素的离子aA2+、bB+、cC3-、dD-都具有相同的电子层结构,则下列叙述正确的是( )
| A. | 原子半径 A>B>D>C | B. | 原子序数 d>c>b>a | ||
| C. | 离子半径 C>D>B>A | D. | 元素的电负性 C>D>A>B |
5.下列所发生的化学反应和实验室用乙醇和浓硫酸制乙烯的化学反应类型相同的是( )
| A. | 环己二烯在脱氢催化剂作用下转变为苯和氢气 | |
| B. | 溴乙烷在NaOH的乙醇溶液中的反应 | |
| C. | 乙酸和乙醇在浓硫酸的作用下生成乙酸乙酯和水 | |
| D. | 乙醛能将新制的Cu(OH)2还原成Cu2O |
12.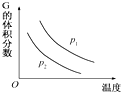 在一密闭容器中有如下反应:L(s)+aG(g)═bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )
在一密闭容器中有如下反应:L(s)+aG(g)═bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )
 在一密闭容器中有如下反应:L(s)+aG(g)═bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )
在一密闭容器中有如下反应:L(s)+aG(g)═bR(g),温度和压强对该反应的影响如图所示,其中压强p1<p2,由此可判断( )| A. | 正反应为放热反应 | B. | 化学方程式中的计量数a>b | ||
| C. | G的转化率随温度升高而减小 | D. | 增大压强,容器内气体的质量变大 |
2.运用元素周期律分析下面的推断,其中错误的是( )
| A. | 铍(Be)的氧化物的水化物可能具有两性 | |
| B. | 砹(At2)为有色固体;HAt不稳定;AgAt不溶于水也不溶于稀酸 | |
| C. | 硫酸锶(SrSO4)是难溶于水的白色固体 | |
| D. | 硒化氢(H2Se)是比H2S稳定的气体 |
9.下列物质中可用作光导纤维的是( )
| A. | 单晶硅 | B. | 石英 | C. | 陶瓷 | D. | 水玻璃 |
6.已知1~18号元素的离子W3+、X+、Y2-、Z-都具有相同的电子层结构,下列关系正确的是( )
| A. | 元素原子失电子能力:X>W | B. | 离子的还原性:Z->Y2- | ||
| C. | 氢化物的稳定性:H2Y>HZ | D. | 原子半径:X<W |
7.下列说法正确的是( )
| A. | 明矾溶于水产生Al(OH)3 胶体,离子方程式可表示为:Al3++3H2O═Al(OH)3↓+3H+ | |
| B. | 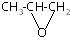 和CO2反应生成可降解聚合物 和CO2反应生成可降解聚合物 ,该反应符合绿色化学的原则 ,该反应符合绿色化学的原则 | |
| C. | 用乙醇和浓H2SO4制备乙烯时,可用水浴加热控制反应的温度 | |
| D. | 聚氯乙烯塑料制品可用于食品的包装 |