��Ŀ����
20�����ڱ��ǻ�ѧ��չ�����о�����̱�����Ĺ���֮һ����ش��������⣮
��1��������Ԫ�����ڱ��л�������Ԫ����ǽ���Ԫ�صķֽ��ߣ�
��2������ NaH �Ĵ��ڣ���������ɰ���Ԫ�ط��ڢ�A �壬��ô���������������ϵ��۵ľ���ֵ��ȣ��ֿɰ���Ԫ�ط������ڱ��е�IVA�壮
��3�����мס�������Ԫ�أ���Ԫ��ԭ�Ӻ����3������7�����ӣ���Ԫ�ص���ɫ��Ӧ�ǻ�ɫ��
����Ԫ�ط��Ž��ס�����Ԫ����д������Ԫ�����ڱ��ж�Ӧ��λ�ã�
�ڼ�Ԫ������Ԫ����Ƚϣ��ǽ����Խ�ǿ�����ȣ������ƣ�
���� ��1��ÿһ�����У�������Ԫ������������������ȵ�Ԫ�ؿ�ʼ���ҵ�Ԫ��Ϊ�ǽ���Ԫ�أ�
��2����IVA��Ԫ����������ϼ�����ϵ��۾���ֵ��ȣ�
��3����Ԫ��ԭ�Ӻ����3������7�����ӣ������ClԪ�أ���Ԫ�ص���ɫ��Ӧ�ǻ�ɫ��������NaԪ�أ�
�ټ�λ�ڵ������ڵ�VIIA����λ�ڵ������ڵ�IA�壻
��ͬһ����Ԫ�أ�Ԫ�صķǽ���������ԭ�������������ǿ��
��� �⣺��1��ÿһ�����У�������Ԫ������������������ȵ�Ԫ�ؿ�ʼ���ҵ�Ԫ��Ϊ�ǽ���Ԫ�أ����������ڱ��н����ͷǽ����ֽ���Ϊ ��
��
�ʴ�Ϊ�� ��
��
��2����IVA��Ԫ����������ϼ�����ϵ��۾���ֵ��ȣ�HԪ������ϼ�Ϊ+1�ۡ���ͻ��ϼ�Ϊ-1�ۣ����߾���ֵ��ȣ����Կ���λ�ڵ�IVA�壬�ʴ�Ϊ����A��
��3����Ԫ��ԭ�Ӻ����3������7�����ӣ������ClԪ�أ���Ԫ�ص���ɫ��Ӧ�ǻ�ɫ��������NaԪ�أ�
�ټ�λ�ڵ������ڵ�VIIA����λ�ڵ������ڵ�IA�壬���������ڱ��е�λ��Ϊ ��
��
�ʴ�Ϊ�� ��
��
��ͬһ����Ԫ�أ�Ԫ�صķǽ���������ԭ�������������ǿ��S��Clλ��ͬһ���ڣ���ԭ������Cl��S����ǽ�����Cl��S���ʴ�Ϊ���ȣ�
���� ���⿼��Ԫ�����ڱ���Ԫ���������ۺ�Ӧ�ã���ȷԪ�����ڱ��ṹ��Ԫ���������й�֪ʶ���ɽ�𣬻����ԭ�ӽṹʾ��ͼ�ж�Ԫ�������ڱ��е�λ�ã���Ŀ�ѶȲ���

| A�� | ��״���£���һ���������ĸ�����ƿ����Ȫʵ�飬��ˮ����������ƿ������Һ�����磩����ƿ�ڰ�ˮ�����ʵ�����Ũ��Ϊ$\frac{1}{22.4}$ mol/L | |
| B�� | ��������Һ������˰������������ | |
| C�� | SO3����ˮ�ܵ��磬����SO3�ǵ���� | |
| D�� | Ũ�����ڹ��������±�ƣ�˵��Ũ����ȶ������ɵ���ɫ����������Ũ���� |
| A�� | ԭ�Ӱ뾶 A��B��D��C | B�� | ԭ������ d��c��b��a | ||
| C�� | ���Ӱ뾶 C��D��B��A | D�� | Ԫ�صĵ縺�� C��D��A��B |
| A�� | ��A��Ԫ�� | B�� | +7��Ԫ�� | C�� | ������Ԫ�� | D�� | ����Ԫ�� |
| A�� | ������ϩ���������������ת��Ϊ�������� | |
| B�� | ��������NaOH���Ҵ���Һ�еķ�Ӧ | |
| C�� | ������Ҵ���Ũ�������������������������ˮ | |
| D�� | ��ȩ�ܽ����Ƶ�Cu��OH��2��ԭ��Cu2O |
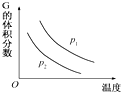 ��һ�ܱ������������·�Ӧ��L��s��+aG��g���TbR��g�����¶Ⱥ�ѹǿ�Ը÷�Ӧ��Ӱ����ͼ��ʾ������ѹǿp1��p2���ɴ˿��жϣ�������
��һ�ܱ������������·�Ӧ��L��s��+aG��g���TbR��g�����¶Ⱥ�ѹǿ�Ը÷�Ӧ��Ӱ����ͼ��ʾ������ѹǿp1��p2���ɴ˿��жϣ�������| A�� | ����ӦΪ���ȷ�Ӧ | B�� | ��ѧ����ʽ�еļ�����a��b | ||
| C�� | G��ת�������¶����߶���С | D�� | ����ѹǿ�������������������� |
| A�� | ������ | B�� | ʯӢ | C�� | �մ� | D�� | ˮ���� |
| A�� | CH3CO- | B�� |  | C�� |  | D�� | R-CO- |
