题目内容
6.下列说法中错误的是( )
| A. | 如图所示的化学反应为放热反应 | |
| B. | 化学反应中有物质变化也有能量变化 | |
| C. | 需要加热的化学反应不一定是吸热反应 | |
| D. | 断裂化学键消耗能量,形成化学键放出能量 |
分析 A.根据图示中反应物与生成物能量高低进行判断;
B.化学反应一定有新物质的生成,同时一定伴随着能量变化;
C.很多放热反应,需要点燃或者加热才能使反应进行,溶液氧气与氢气的反应为放热反应,该反应需要点燃才能进行;
D.化学反应中,旧的化学键断裂需要吸收能量,新的化学键生成过程中会放出能量.
解答 解:A.由图示可知,在反应过程中,反应物总能量小于生成物总能量,该反应一定为吸热反应,故A错误;
B.有新的物质生成的反应为化学反应,所以化学反应一定有物质变化,并且反应过程中一定伴随着能量变化,通常以热量的形式释放出来,故B正确;
C.吸热反应不一定需要加热才能进行,如氢氧化钡晶体与氯化铵的反应;加热条件下能够进行的反应不一定为吸热反应,反应吸热还是放热与反应物和生成物总能量大小有关,与反应条件没有必然关系,故C正确;
D.化学反应中,旧的化学键断裂需要吸收能量,新的化学键生成会放出能量,所以化学反应中一定伴随着能量变化,故D正确;
故选A.
点评 本题考查了化学反应与能量变化,题目难度不大,注意明确化学反应的实质,任何化学反应中一定伴随着能量变化,还要明确放热反应、吸热反应与反应条件没有必然关系.

练习册系列答案
 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案
相关题目
12.萘的结构简式为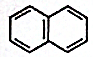 ,它与硝酸反应,可生成苯环上的一硝基取代物( )
,它与硝酸反应,可生成苯环上的一硝基取代物( )
 ,它与硝酸反应,可生成苯环上的一硝基取代物( )
,它与硝酸反应,可生成苯环上的一硝基取代物( )| A. | 1种 | B. | 2种 | C. | 3种 | D. | 4种 |
1.下列实验能达到实验目的且符合安全要求的是( )
| A. |  制备并检验氢气的可燃性 | B. |  除去CO2中的HCl | ||
| C. | 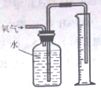 测量O2的体积 | D. | 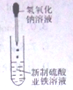 制备氢氧化亚铁并观察其颜色 |
11.可以通过图示装置实现下列实验目的是( )
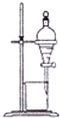

| A. | 分离乙酸和乙酸乙酯 | B. | 分离苯和苯酚钠溶液 | ||
| C. | 分离苯和硝基苯 | D. | 分离苯和溴苯 |
15. (1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
若有17g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为226.3kJ.
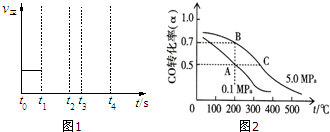
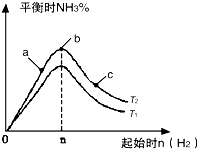
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)?2NH3(g)反应的影响.实验结果如图所示:
(图中T表示温度,n表示物质的量)
①图象中T2和T1的关系是:T2低于T1(填“高于”“低于”“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是c(填字母).
(3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)═4NO2(g)+O2(g)△H>0下表为反应在T1温度下的部分实验数据
则500s内NO2的平均生成速率为0.00592 mol•L-1•s-1.
 (1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/mol
(1)已知:N2(g)+O2(g)═2NO(g)△H=+180.5kJ/molN2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ/mol
若有17g 氨气经催化氧化完全生成一氧化氮气体和水蒸气所放出的热量为226.3kJ.
(2)某科研小组研究:在其他条件不变的情况下,改变起始物氢气的物质的量对N2(g)+3H2(g)?2NH3(g)反应的影响.实验结果如图所示:
(图中T表示温度,n表示物质的量)
①图象中T2和T1的关系是:T2低于T1(填“高于”“低于”“等于”“无法确定”)
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最高的是c(填字母).
(3)N2O5是一种新型硝化剂,其性质和制备受到人们的关注.
一定温度下,在恒容密闭容器中N2O5可发生下列反应:2N2O5(g)═4NO2(g)+O2(g)△H>0下表为反应在T1温度下的部分实验数据
| t/s | 0 | 500 | 1000 |
| c(N2O5)/mol•L-1 | 5.00 | 3.52 | 2.48 |
16.只用一种试剂一次性鉴别NH4Cl、Na2SO4、(NH4)2SO4三种物质的试剂是(可加热)( )
| A. | AgNO3 | B. | 稀H2SO4 | C. | 稀HCl | D. | Ba(OH)2溶液 |
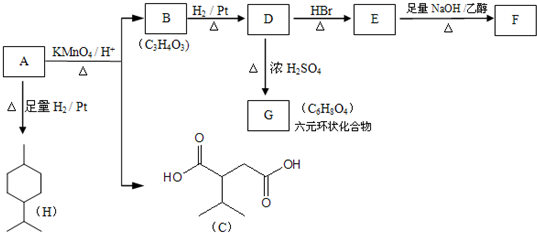
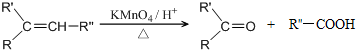
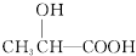 $→_{△}^{浓H_{2}SO_{4}}$
$→_{△}^{浓H_{2}SO_{4}}$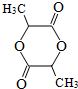 +2H2O.
+2H2O.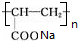 .
.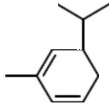 .
.