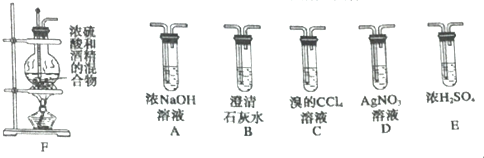
题目内容
14.“洁净煤技术”研究在世界上相当普遍,科研人员通过向地下煤层气化炉中交替鼓入空气和水蒸气的方法,连续产出了高热值的煤炭气,其主要成分是CO和H2.CO和H2可作为能源和化工原料,应用十分广泛.生产煤炭气的反应之一是:C(s)+H2O(g)?CO(g)+H2(g)-131.4kJ.(1)在容积为3L的密闭容器中发生上述反应,5min后容器内气体的密度增大了0.12g/L,用H2O表示0~5miin的平均反应速率为0.002mol/(L•min).
(2)能说明该反应已达到平衡状态的是bd(选填编号).
a.v正(C)=v逆(H2O) b.容器中CO的体积分数保持不变
c.c(H2)=c(CO) d.炭的质量保持不变
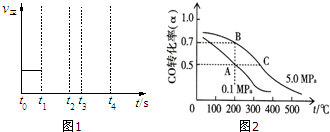
(3)若上述反应在t0时刻达到平衡(如图1),在t1时刻改变某一条件,请在图中继续画出t1时刻之后正反应速率随时间的变化:
①缩小容器体积,t2时到达平衡(用实线表示);
②t3时平衡常数K值变大,t4到达平衡(用虚线表示).
(4)在一定条件下用CO和H2经如下两步反应制得甲酸甲酯:
Ⅰ.CO(g)+2H2(g)?CH3OH(g)
Ⅱ.CO(g)+CH3OH(g)?HCOOCH3(g)
①反应①中CO的平衡转化率(α)与温度、压强的关系如图2所示.在不改变反应物用量的情况下,为提高CO的转化率可采取的措施是降温、加压;将甲醇从混合体系中分离出来.
②已知反应①中CO的转化率为80%,反应②中两种反应物的转化率均为85%,则5.04kgCO最多可制得甲酸甲酯4.08kg.
分析 (1)(1)根据反应方程式可知,气体增加的质量为固体碳的质量,根据m=ρV计算出反应消耗碳的质量,然后根据n=$\frac{m}{M}$计算出其物质的量,最后根据反应方程式及反应速率表达式计算出用H2O表示0~5miin的平均反应速率;
(2)可逆反应达到平衡状态时,正逆反应速率相等,各组分的浓度、百分含量不再变化,据此进行判断;
(3)根据影响化学反应速率的因素画出正反应速率变化的曲线;
(4)①提高CO的转化率可采取的措施是改变条件促使平衡正向进行;
②结合反应转化率从质量守恒的角度列式计算.
解答 解:(1)在容积为3L的密闭容器中发生上述反应,5min后容器内气体的密度增大了0.12g/L,根据反应C(s)+H2O(g)?CO(g)+H2(g)可知,气体增加的质量为参加反应的固体C的质量,则反应消耗碳的物质的量为:$\frac{0.12g/L×3L}{12g/mol}$=0.03mol,该反应过程中消耗水的物质的量也为0.03mol,则用H2O表示0~5miin的平均反应速率为:$\frac{\frac{0.03mol}{3L}}{5min}$=0.002mol/(L•min),
故答案为:0.002mol/(L•min);
(2)a.v正(C)=v逆(H2O):炭为固体,不存在浓度变化,无法表示反应速率,则无法判断是否达到平衡状态,硅a错误;
b.容器中CO的体积分数保持不变,说明各组分的浓度不再变化,已经达到平衡状态,故b正确;
c.c(H2)=c(CO),不能判断正逆反应速率是否相等,则无法判断是否达到平衡状态,故c错误;
d.炭的质量保持不变,则说明正逆反应速率相等,该反应已经达到平衡状态,故d正确;
故答案为:bd;
(3)①t1时缩小容器体积,反应体系的压强增大,正逆反应速率都增大,直至t2时重新达到平衡;
②t3时平衡常数K增大,说明平衡向着正向移动,说明升高了温度,之后正反应速率逐渐减小,直至达到新的平衡,
根据以上分析画出的图象为: ,
,
故答案为: .
.
(4)①反应是气体体积减小的放热反应,提高CO的转化率可采取的措施是降温、加压、分离出甲醇,
故答案为:降温、加压、将甲醇从混合体系中分离出来;
②n(CO)=$\frac{5.04×1{0}^{3}g}{28g/mol}$=180mol,
设用于制备甲醇的CO物质的量为x,用于和甲醇反应的CO为y,
则:x+y=180mol、80%x=y,
解得:x=100mol,y=80mol,
n(HCOOCH3)=80mol×85%=68mol,
m(HCOOCH3)=68mol×60g/mol=4.08×103g=4.08kg,
故答案为:4.08.
点评 本题考查了化学平衡的计算、化学平衡状态的判断、化学平衡的影响因素等知识,题目难度中等,明确影响化学反应速率的因素为解答关键,试题侧重考查学生的分析能力及化学计算能力.

| A. | 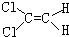 | B. | 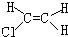 | C. | 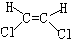 | D. | 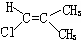 |
(1)CuFeS2中Fe的化合价为+2,上述反应中被氧化的元素是Fe和CuFeS2中的S.
(2)工业生产中利用上述反应后的溶液,按如图甲流程可制备胆矾(CuSO4•5H2O):
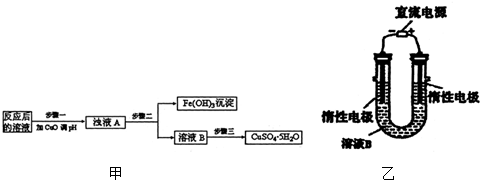
①分析表格(其中KSP是相应金属氢氧化物的沉淀溶解平衡常数):
| Ksp | 氢氧化物开始沉淀时的pH | 氢氧化物沉淀完全时的pH | |
| Fe3+ | 2.6×10-39 | 1.9 | 3.2 |
| Cu2+ | 2.2×10-20 | 4.7 | 6.7 |
②步骤三中的具体操作方法是蒸发浓缩,冷却结晶.
(3)有人提出可以利用图乙的装置从溶液B中提炼金属铜.该过程中图乙电极的反应式是4OH--4e-=O2↑+2H2O,总反应的方程式是2CuSO4+2H2O$\frac{\underline{\;电解\;}}{\;}$2Cu+2H2SO4+O2↑.

| A. | 如图所示的化学反应为放热反应 | |
| B. | 化学反应中有物质变化也有能量变化 | |
| C. | 需要加热的化学反应不一定是吸热反应 | |
| D. | 断裂化学键消耗能量,形成化学键放出能量 |
①MnO2+H2O2+2H+=Mn2++O2↑+2H2O
②Mn2++H2O2=MnO2+2H+
下列说法正确的是( )
| A. | H2O2在①中是氧化剂,在②中是还原剂 | |
| B. | 在①中每生成1 mol O2,转移的电子数为1.204×1024 | |
| C. | Mn2+在①中是还原产物,在②中是氧化产物 | |
| D. | 在二氧化锰催化作用下,1 mol H2O2分解生成22.4 L O2 |

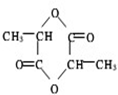 .
. 某温度时,在2L容器中A、B、C三种物质的物质的量浓度随时间变化关系曲线如图所示.
某温度时,在2L容器中A、B、C三种物质的物质的量浓度随时间变化关系曲线如图所示.