题目内容
4.如表为元素周期表的一部分,列出了7种元素在元素周期表中的位置: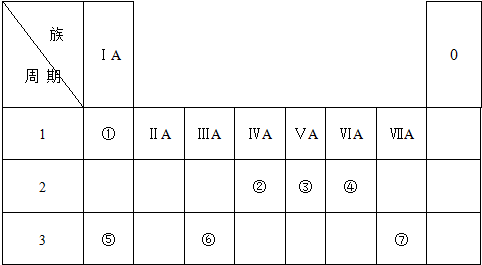
请按要求回答下列问题(用化学用语回答):
(1)写出④的单核离子结构示意图:
 ,③与①所形成的化合物的结构式为:
,③与①所形成的化合物的结构式为: .
.(2)7种元素中,原子半径最小的是:H(填元素符号).
(3)用电子式表示元素②与④最高价化合物的形成过程:
 .
.(4)元素⑤和元素⑥最高价氧化物的水化物相互反应的化学方程式为:Al(OH)3+NaOH=NaAlO2+2H2O.
(5)元素④的氢化物与元素⑦的单质反应的离子方程式为:Cl2+H2O=H++Cl-+HClO.
分析 由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Cl,结合对应单质、化合物的性质以及元素周期率知识解答该题.
解答 解:由元素在周期表中位置,可知①为H、②为C、③为N、④为O、⑤为Na、⑥为Al、⑦为Cl,
(1)元素、④为O元素,原子核外有2个电子层,最外层电子数为6,得到2个电子形成8个电子的稳定结构,离子结构示意图为 ,③与①所形成的化合物为氨气,氨气是氮原子和氢原子之间通过共价单键形成的三角锥形结构,结构式为:
,③与①所形成的化合物为氨气,氨气是氮原子和氢原子之间通过共价单键形成的三角锥形结构,结构式为: ,故答案为:
,故答案为: ;
; ;
;
(2)H原子只有1个电子层,其原子半径最小,故答案为:H;
(3)②与④最高价化合物为CO2,二氧化碳是氧原子和碳原子之间通过共价键形成的共价化合物,形成过程为 ,故答案为:
,故答案为: ;
;
(4)氢氧化铝为两性氢氧化物,能与氢氧化钠反应生成偏铝酸钠和水,反应方程式为Al(OH)3+NaOH=NaAlO2+2H2O,故答案为:Al(OH)3+NaOH=NaAlO2+2H2O;
(5)元素O的氢化物为水,氯气与水反应生成盐酸和次氯酸,氧化物不能拆,单质不能拆,此反应的离子方程式为Cl2+H2O=H++Cl-+HClO,故答案为:Cl2+H2O=H++Cl-+HClO.
点评 本题考查元素的推断以及原子结构、物质的性质等知识,题目难度不大,本题注意有关电子式和反应的离子的方程方程式的书写,加强化学用语的学习.

练习册系列答案
 轻松暑假总复习系列答案
轻松暑假总复习系列答案
相关题目
18.已知某温度下,K甲(AgCl)=1.56×10-10mol2•L-2,K甲(Ag2CrO4)=1×10-12mol3•L-3,下列叙述正确的是( )
| A. | 饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 | |
| B. | 向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小 | |
| C. | 向0.0008mol/L的K2CrO4溶液中加入等体积的0.002mol/LAgNO3溶液,则CrO42-完全沉淀 | |
| D. | 将0.001mol/L的AgNO3溶液滴入0.001mol/L的KCl和0.001mol/L的K2CrO4溶液,则先产生AgCl沉淀 |
19.在反应A+2HCl═MgCl2+2B中A可能是下列物质中的( )
| A. | Mg | B. | MgO | C. | Mg(OH)2 | D. | MgCO3 |
12.下表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号或化学式,下同).原子结构示意图为 .
.
(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的是:KOH.
(3)最高价氧化物是两性氧化物的元素是Al;写出它的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(4)用电子式表示元素④与⑥的化合物的形成过程: ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.
(5)元素的气态氢化物中成碱性的物质是NH3,该元素氢化物与其最高价氧化物对应水化物反应的化学方程式为NH3+HNO3=NH4NO3.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
 .
.(2)在最高价氧化物的水化物中,酸性最强的化合物的分子式是HClO4,碱性最强的化合物的是:KOH.
(3)最高价氧化物是两性氧化物的元素是Al;写出它的最高价氧化物对应的水化物与氢氧化钠反应的离子方程式Al(OH)3+OH-=AlO2-+2H2O.
(4)用电子式表示元素④与⑥的化合物的形成过程:
 ,该化合物属于离子(填“共价”或“离子”)化合物.
,该化合物属于离子(填“共价”或“离子”)化合物.(5)元素的气态氢化物中成碱性的物质是NH3,该元素氢化物与其最高价氧化物对应水化物反应的化学方程式为NH3+HNO3=NH4NO3.
19.根据元素周期表和元素周期律,下列推断中错误的是( )
| A. | 砹是一种有色固体,它的气态氢化物很不稳定 | |
| B. | F2与水反应比Cl2与水反应剧烈 | |
| C. | 铷的最高价氧化物的水化物一定是强碱 | |
| D. | 由盐酸的酸性比氢硫酸强可推知氯的非金属性强于硫 |
9. 甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g)+Q,甲醇的平衡转化率随温度变化曲线如图所示.下列有关说法正确的是( )
甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g)+Q,甲醇的平衡转化率随温度变化曲线如图所示.下列有关说法正确的是( )
 甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g)+Q,甲醇的平衡转化率随温度变化曲线如图所示.下列有关说法正确的是( )
甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g)+Q,甲醇的平衡转化率随温度变化曲线如图所示.下列有关说法正确的是( )| A. | Q>0 | B. | 600K时,Y点甲醇的υ(正)<υ(逆) | ||
| C. | 从Y点到Z点可通过增大压强实现 | D. | 从Y点到X点可通过使用催化剂实现 |
16.摩托罗拉公司研发了一种以甲醇为原料的新型手机电池,其容量为锂电池的10倍,可连续使用一个月才充一次电,其电池反应原理为:2CH3OH+3X+4NaOH═2Na2CO3+6H2O,其中X的化学式是( )
| A. | O2 | B. | CO | C. | CO2 | D. | H2 |
13.有一种石灰石样品,其中含有的杂质是二氧化硅(它是一种不溶于水,也不与盐酸反应,耐高温的固体物质),某同学想测定该样品的纯度,他取用2g这种石灰石样品,把20g稀盐酸分四次加入,充分反应后剩余固体的质量见下表所示:
(1)2g石灰石样品中的杂质质量是;
(2)石灰石样品的纯度为;
(3)100Kg这种纯度的石灰石充分煅烧后,可得到固体多少克?
| 稀盐酸的质量 | 剩余固体的质量 |
| 第1次加入5g | 1.315g |
| 第2次加入5g | 0.63g |
| 第3次加入5g | 0.3g |
| 第4次加入5g | 0.3g |
(2)石灰石样品的纯度为;
(3)100Kg这种纯度的石灰石充分煅烧后,可得到固体多少克?