题目内容
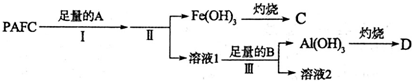
9. 甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g)+Q,甲醇的平衡转化率随温度变化曲线如图所示.下列有关说法正确的是( )
甲醇脱氢可制取甲醛CH3OH(g)?HCHO(g)+H2(g)+Q,甲醇的平衡转化率随温度变化曲线如图所示.下列有关说法正确的是( )| A. | Q>0 | B. | 600K时,Y点甲醇的υ(正)<υ(逆) | ||
| C. | 从Y点到Z点可通过增大压强实现 | D. | 从Y点到X点可通过使用催化剂实现 |
分析 A、甲醇脱氢反应为吸热反应还是放热反应由温度对平衡移动的影响确定;
B、600K时Y点甲醇转化率大于X点甲醇平衡转化率;
C、增大压强,平衡向逆反应方向移动,甲醇转化率减小;
D、使用催化剂平衡不移动.
解答 解:A、由图可知,温度越高甲醇平衡转化率越大,说明升高温度化学平衡正向移动,因此甲醇脱氢反应为吸热反应即△H>0,所以Q<0,故A错误;
B、600K时Y点甲醇转化率大于X点甲醇平衡转化率,说明反应逆向进行即:υ(正)<υ(逆),故B正确;
C、由图可知Y点和Z点甲醇转化率相等,若增大压强,平衡向逆反应方向移动,甲醇转化率减小,则甲醇的转化率将小于Z点甲醇转化率,故C错误;
D、Y点和X点两点甲醇的平衡转化率不同,如果从Y点到X点平衡发生移动,所以不是使用催化剂,故D错误.
故选:B.
点评 本题考查化学平衡影响因素、化学平衡常数及其计算等,从图中提取有用信息的能力尤为关键,难度中等,注意基础知识理解掌握.

练习册系列答案
相关题目
3.物质W,Z之间有反应:4W+O2+2H2O=4Z,下列说法正确的是( )
| A. | 物质W和Z所含的元素可能相同也可能不相同 | |
| B. | 若W是一种气体,它可由氨气的催化氧化直接生成 | |
| C. | 物质W和Z所含有的某种元素,可能是地壳中或空气中含量最高的 | |
| D. | 每转移1mol电子,消耗氧气5.6L |
4.由乙烯和无机试剂制备二乙酸乙二酯,不可能涉及的反应类型是( )
| A. | 加成反应 | B. | 消去反应 | C. | 取代反应 | D. | 氧化反应 |
14.国际互联网上报道:“目前世界上有近20亿人患有缺铁性贫血”.我国政府 即将启动“酱油补铁工程”.这里的铁指( )
| A. | 铁元素 | B. | 铁单质 | C. | 四氧化三铁 | D. | 三氧化二铁 |
1.电子数相同,质子数不同的两种粒子,它们可能是( )
| A. | 两种不同元素的原子 | B. | 两种不同元素的离子 | ||
| C. | 两种不同分子 | D. | 两种元素的原子和离子 |
19.用电火花点燃装在一密闭容器中的一种气态烃和足量的氧气,完全燃烧后,容器内气体体积保持不变(气体体积均在120℃和相同的压强下测定),这种气态烃不可能是( )
| A. | CH4 | B. | C2H4 | C. | C3H4 | D. | C3H6 |
 ,③与①所形成的化合物的结构式为:
,③与①所形成的化合物的结构式为: .
. .
.