题目内容
14.据报道,只含镁、镍和碳三种元素的晶体具有超导性.该晶体的结构可看作由镁原子和镍原子在一起进行面心立方密堆积,晶胞结构如下图所示,试写出该晶体的化学方程式MgCNi3,晶体中每个镁原子周围距离最近的镍原子有12个.晶体中每个镁原子周围距离最近的镁原子有6个.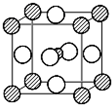
分析 根据均摊法计算晶胞中各原子个数,进而确定化学式;Mg原子处于顶点,与之最近的Ni原子处于面心,每个顶点为12面共用;Mg原子处于顶点,与所在棱上的Mg原子距离最近,顶点原子为8个晶胞共用,故晶体中每个镁原子周围距离最近的Mg原子有6个.
解答 解:碳原子位于晶胞体心,只有1个C原子,镁位于顶点,晶胞中Mg原子数目为8×$\frac{1}{8}$=1,镍位于面心,每个镍原子被两个晶胞共用,故每个晶胞中镍原子个数为6×$\frac{1}{2}$=3,故晶体化学式为MgCNi3;
Mg原子处于顶点,与之最近的Ni原子处于面心,每个顶点为12面共用,故晶体中每个镁原子周围距离最近的镍原子有12个;
Mg原子处于顶点,与所在棱上的Mg原子距离最近,顶点原子为8个晶胞共用,补全晶胞可知,晶体中每个镁原子周围距离最近的Mg原子有6个,
故答案为:MgCNi3;12;6.
点评 本题考查晶胞结构与晶胞计算,需要学生具有一定的空间想象力,注意利用均摊法进行计算,难度不大.

练习册系列答案
相关题目
5.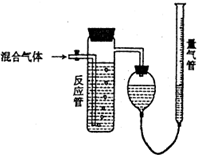 测量SO2、N2、O2混合气体中SO2含量的装置如图:反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI,反应管内溶液蓝色消失后,没有及时停止通气,测得的SO2的体积分数( )
测量SO2、N2、O2混合气体中SO2含量的装置如图:反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI,反应管内溶液蓝色消失后,没有及时停止通气,测得的SO2的体积分数( )
 测量SO2、N2、O2混合气体中SO2含量的装置如图:反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI,反应管内溶液蓝色消失后,没有及时停止通气,测得的SO2的体积分数( )
测量SO2、N2、O2混合气体中SO2含量的装置如图:反应管中装有碘的淀粉溶液.SO2和I2发生的反应为(N2、O2不与I2反应):SO2+I2+2H2O→H2SO4+2HI,反应管内溶液蓝色消失后,没有及时停止通气,测得的SO2的体积分数( )| A. | 偏高 | B. | 偏低 | C. | 无影响 | D. | 无法确定 |
9.下列有关化学实验的叙述正确的是( )
| A. | 为了增强高锰酸钾溶液的氧化能力,用稀盐酸将高锰酸钾溶液进行酸化 | |
| B. | 欲制备Fe(OH)3胶体,向盛有沸水的烧杯中滴加FeCl3饱和溶液并长时间煮沸 | |
| C. | 用稀盐酸洗涤盛放过石灰水的试剂瓶 | |
| D. | 欲配制质量分数为10%的ZnSO4溶液,将10 g ZnSO4•7H2O溶解在90 g水中 |
19.用电火花点燃装在一密闭容器中的一种气态烃和足量的氧气,完全燃烧后,容器内气体体积保持不变(气体体积均在120℃和相同的压强下测定),这种气态烃不可能是( )
| A. | CH4 | B. | C2H4 | C. | C3H4 | D. | C3H6 |
3.下列说法正确的是( )
| A. | 易溶于水的电解质一定是强电解质,难溶于水的电解质一定是弱电解质 | |
| B. | 强电解质溶液的导电能力一定比弱电解质溶液强 | |
| C. | NaCl溶液在电流的作用下电离成钠离子和氯离子 | |
| D. | 氯化钠晶体不导电是由于氯化钠晶体中不存在自由移动的离子 |
4.研究表明生命起源于火山爆发,是因为火山爆发产生的气体中含有1%的羰基硫(COS),已知羰基硫分子中所有原子均满足八电子结构,结合周期表知识,有关说法不正确的是( )
| A. | 羰基硫分子为非极性分子 | |
| B. | 羰基硫的结构式为:O=C=S | |
| C. | 羰基硫沸点比CO2高 | |
| D. | 羰基硫分子中三个原子处于同一直线上 |

 ,③与①所形成的化合物的结构式为:
,③与①所形成的化合物的结构式为: .
. .
.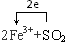
 ;②NH3的稳定性比PH3强(填写“强”或“弱”).
;②NH3的稳定性比PH3强(填写“强”或“弱”).