题目内容
18.已知某温度下,K甲(AgCl)=1.56×10-10mol2•L-2,K甲(Ag2CrO4)=1×10-12mol3•L-3,下列叙述正确的是( )| A. | 饱和AgCl溶液与饱和Ag2CrO4溶液相比,前者的c(Ag+)大 | |
| B. | 向氯化银的浊液中加入氯化钠溶液,氯化银的Ksp减小 | |
| C. | 向0.0008mol/L的K2CrO4溶液中加入等体积的0.002mol/LAgNO3溶液,则CrO42-完全沉淀 | |
| D. | 将0.001mol/L的AgNO3溶液滴入0.001mol/L的KCl和0.001mol/L的K2CrO4溶液,则先产生AgCl沉淀 |
分析 A、饱和AgCl溶液中c2(Ag+)=Ksp(AgCl)=1.56×10-10,饱和Ag2CrO4溶液中$\frac{{c}^{3}(A{g}^{+})}{2}$=Ksp(Ag2CrO4)=1×10-12,由此分析解答;
B、AgCl的Ksp只与温度有关,与离子的浓度有关;
C、先让两者反应,然后根据剩余银离子,结合溶度积求CrO42-离子的浓度与1.0×10-5mol/L比较;
D、根据Ksp(AgCl)、Ksp(Ag2CrO4),则当Cl-、CrO42-开始沉淀时c(Ag+)各是多少.
解答 解:A、饱和AgCl溶液中c2(Ag+)=Ksp(AgCl)=1.56×10-10,饱和Ag2CrO4溶液中$\frac{{c}^{3}(A{g}^{+})}{2}$=Ksp(Ag2CrO4)=1×10-12,显然后者的c(Ag+)大,故A错误;
B、AgCl的Ksp只与温度有关,向AgBr的浊液中加入溴化钠溶液,虽然平衡向逆方向移动,但Ksp不变,故B错误;
C、两溶液混合后则c(K2CrO4)=0.0004 mol/L,c(AgNO3)=0.001 mol/L,根据2Ag++CrO42-=Ag2CrO4↓,则溶液中剩余的c(Ag+)=0.001-0.0004×2=0.0002 mol/L,根据Ksp(K2CrO4),则生成沉淀后的溶液中c(CrO42-)$\frac{Ksp(A{g}_{2}Cr{O}_{4})}{{c}^{2}(A{g}^{+})}=\frac{1×1{0}^{-12}}{(0.0002)^{2}}$=2.5×10-5mol/L>1.0×10-5mol/L,溶液中存在难溶物的溶解平衡,所以CrO42-不能完全沉淀,故C错误;
D、根据Ksp(AgCl)、Ksp(Ag2CrO4),则当Cl-开始沉淀时c(Ag+)=$\frac{Ksp(AgCl)}{c(C{l}^{-})}$=1.56×10-7mol/L,当CrO42-开始沉淀时c(Ag+)=$\sqrt{\frac{Ksp(A{g}_{2}Cr{O}_{4})}{c(Cr{{O}_{4}}^{2-})}}$=1.0×10-3 mol/L,故先产生AgCl沉淀,故D正确;故选:D.
点评 本题考查溶度积常数的有关计算、判断离子是否完全,沉淀等问题,综合性强,难度较大.

 寒假大串联黄山书社系列答案
寒假大串联黄山书社系列答案 寒假创新型自主学习第三学期寒假衔接系列答案
寒假创新型自主学习第三学期寒假衔接系列答案| A. | H2SO4 | B. | HCl | C. | HClO | D. | Ba(HSO3)2 |
| A. | NH3属于离子化合物 | |
| B. | 常温下,液氨的电离平衡常数为10-14 | |
| C. | 液态氨与氨水的组成相同 | |
| D. | 液氨中的微粒含相同的电子数 |
| 选项 | A | B | C | D |
| n(H2SO4)/mol | 2 | 3 | 4 | 5 |
| n(沉淀)/mol | 2 | 3 | 2 | 1.5 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 物质W和Z所含的元素可能相同也可能不相同 | |
| B. | 若W是一种气体,它可由氨气的催化氧化直接生成 | |
| C. | 物质W和Z所含有的某种元素,可能是地壳中或空气中含量最高的 | |
| D. | 每转移1mol电子,消耗氧气5.6L |
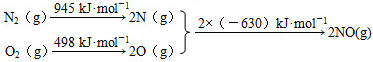 N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1.
N2(g)+O2(g)=2NO(g)△H=+184kJ•mol-1.
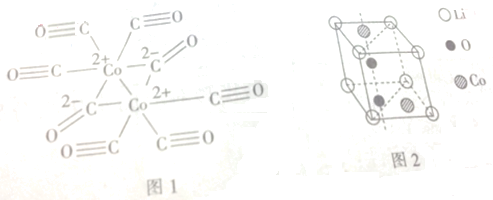
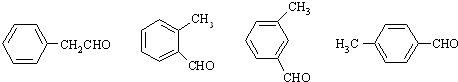 (任选一种).
(任选一种).
 ,③与①所形成的化合物的结构式为:
,③与①所形成的化合物的结构式为: .
. .
.