题目内容
7.某学生为了探究锌与盐酸反应过程中的速率变化.在100mL稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如表:| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50.0 | 120.0 | 232.0 | 290.0 | 312.4 |
(2)在4min~5min时间段内,用盐酸的浓度变化表示的反应速率为0.02mol•L-1•min-1.
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入下列溶液:
A.Na2CO3溶液 B.Na2SO4溶液 C.NaNO3溶液 D.少量CuSO4溶液
你认为不可行的是A、C、D.
分析 (1)在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为50mL、70mL、112mL、68mL、22.4mL,生成气体体积越大的时间段,反应速率越大,结合温度、浓度对反应速率的影响分析;
(2)计算出氢气的体积,根据2HCl~H2,计算消耗盐酸的物质的量,计算浓度的变化,根据v=$\frac{△c}{△t}$计算反应速率;
(3)为了减缓反应速率但不减少产生氢气的量,可降低H+浓度,但不能影响H+的物质的量.
解答 解:(1)在0~1、1~2、2~3、3~4、4~5min时间段中,产生气体的体积分别为50mL、70mL、112mL、68mL、22.4mL,由此可知反应速率最大的时间段为2~3 min,因反应为放热反应,温度升高,反应速率增大,反应速率最小的时间段是4~5min时间段,此时温度虽然较高,但H+浓度小,
故答案为:该反应是放热反应,2 min~3 min时溶液温度最高,反应速率最快;4~5 min;此时反应物的浓度最小,反应速率最慢;
(2)在4min~5min时间段内,n(H2)=$\frac{0.0224L}{22.4L/mol}$=0.001mol,根据2HCl~H2,计算消耗盐酸的物质的量为0.002mol,
则υ(HCl)=$\frac{\frac{0.002mol}{0.1L}}{1min}$=0.02 mol/(L•min),
故答案为:0.02 mol/(L•min);
(3)A.加入Na2CO3,H+浓度减小,反应速率减小,减少产生氢气的量,故A不可行;
B.加入Na2SO4溶液,H+浓度减小,反应速率减小且不减少产生氢气的量,故B可行;
C.加入NaNO3溶液,生成NO气体,影响生成氢气的量,故C不可行;
D.加入CuSO4溶液,Zn置换出Cu反应速度增大,故D不可行;
故答案为:A、C、D.
点评 本题考查反应速率的探究,题目难度不大,本题注意根据把握影响反应速率的因素和反应速率的计算应用.

 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案| A. | 食盐熔化 | B. | 氯化氢溶于水 | C. | 干冰气化 | D. | 金属钠熔化 |
| A. | 纯水在25℃和80℃时的氢离子浓度,前者小于后者 | |
| B. | 常温下,0.01mol/L的NaOH溶液中,由水电离出的c(H+)为10-2mol/L | |
| C. | pH=6的溶液不一定呈酸性,c(H+)>c(OH-)的溶液才是酸性溶液 | |
| D. | 温度升高,水的离子积常数会增大 |
| A. | 加NaCl溶液 | B. | 加水 | ||
| C. | 升高温度(不考虑盐酸挥发) | D. | 滴入几滴浓盐酸 |
| A. | 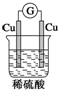 | B. | 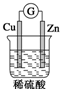 | C. | 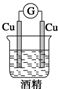 | D. | 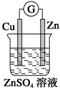 |
| A. | Al3+、H+、AlO2-、Cl- | B. | Cu2+、Fe2+、ClO-、SO42- | ||
| C. | Na+、Ca2+、HCO3-、Cl- | D. | Cu2+、Fe3+、Cl-、NO3- |
| A. | K3C60中既有离子键又有非极性键 | |
| B. | 1mol K3C60中含有的离子数目为3NA | |
| C. | 该晶体在熔融状态下能导电 | |
| D. | 该物质的化学式不能写作KC20 |
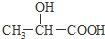 )和乙醇的混合物共1mol,完全燃烧生成54g水和56L(标准状况下测定)CO2,则完全燃烧时消耗氧气物质的量是( )
)和乙醇的混合物共1mol,完全燃烧生成54g水和56L(标准状况下测定)CO2,则完全燃烧时消耗氧气物质的量是( )| A. | 2 mol | B. | 2.25 mol | C. | 3 mol | D. | 3.75 mol |
| A. | 反应条件是加热的反应都是吸热反应 | |
| B. | 化学反应除了生成新的物质外,还伴随着能量的变化 | |
| C. | 物质相互混合就能发生的反应,是放热反应 | |
| D. | 放热的化学反应不需要加热就能发生 |