题目内容
15.过量铁粉与100mL 0.01mol•L-1的稀盐酸反应.为了加快此反应速率而不改变H2的总量,可以使用如下方法中的( )| A. | 加NaCl溶液 | B. | 加水 | ||
| C. | 升高温度(不考虑盐酸挥发) | D. | 滴入几滴浓盐酸 |
分析 过量铁粉与100mL 0.01mol•L-1的稀盐酸反应,为了产生氢气的量不变,则盐酸的量不变;加快反应速率,应增大盐酸的浓度和升高温度.
解答 解:A、加氯化钠溶液,相当于稀释盐酸浓度,则反应速率变慢,故A错误;
B、加水,稀释了盐酸的浓度,则反应速率变慢,故B错误;
C、升高温度,反应速率加快,盐酸的量也没变,所以产生氢气的量不变,故C正确;
D、加浓盐酸,反应速率加快,但盐酸量增多,产生的氢气也增多,故D错误;
故选C.
点评 本题考查了影响反应速率的因素,审题时要注意:加快反应速率和不改变氢气的量.

练习册系列答案
 步步高达标卷系列答案
步步高达标卷系列答案
相关题目
5.下列各组内的物质,属于同系物的是( )
| A. | 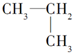 与 与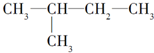 | B. |  与 与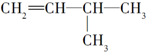 | ||
| C. | HO-CH2-CH2-OH与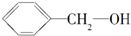 | D. | 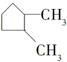 与 与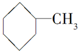 |
6.下列反应属于吸热反应的是( )
| A. | 金属镁与盐酸反应 | B. | 石灰石高温分解 | ||
| C. | 盐酸与氢氧化钠溶液反应 | D. | 二氧化硫和氧气生成三氧化硫 |
3.下列图示实验合理的是( )

| A. | 图1为证明S、C、Si元素的非金属性强弱的装置 | |
| B. | 图2为可随开随停制备少量氧气的装置 | |
| C. | 图3为配制100mL一定浓度硫酸溶液 | |
| D. | 图4制备并收集少量NO2气体 |
10.下列说法中不正确的是( )
| A. | 19世纪中叶,门捷列夫的突出贡献是发现元素周期律 | |
| B. | 在金属和非金属元素交界处最容易找到半导体材料 | |
| C. | 在过渡元素中容易找到各种优良的催化剂和耐高温、耐腐蚀的合金材料 | |
| D. | 根据硼在元素周期表中的位置,推测硼的最高价含氧酸的化学式可能是HBO3 |
20.下列各组混合物中,不论二者以什么比例混合,只要总质量一定,完全燃烧时生成CO2的质量也一定的是( )
| A. | 甲烷、辛醛 | B. | 乙醇、苯乙烯 | C. | 乙酸乙酯、甲酸 | D. | 丙炔、苯 |
7.某学生为了探究锌与盐酸反应过程中的速率变化.在100mL稀盐酸中加入足量的锌粉,标准状况下测得数据累计值如表:
(1)解释2min~3min反应速率最大的原因该反应是放热反应,2min~3min时溶液温度最高,反应速率最快;反应速率最小的时间段是4min~5min,原因为此时反应物的浓度最小,反应速率最慢.
(2)在4min~5min时间段内,用盐酸的浓度变化表示的反应速率为0.02mol•L-1•min-1.
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入下列溶液:
A.Na2CO3溶液 B.Na2SO4溶液 C.NaNO3溶液 D.少量CuSO4溶液
你认为不可行的是A、C、D.
| 时间(min) | 1 | 2 | 3 | 4 | 5 |
| 氢气体积(mL) | 50.0 | 120.0 | 232.0 | 290.0 | 312.4 |
(2)在4min~5min时间段内,用盐酸的浓度变化表示的反应速率为0.02mol•L-1•min-1.
(3)为了减缓反应速率但不减少产生氢气的量,在盐酸中分别加入下列溶液:
A.Na2CO3溶液 B.Na2SO4溶液 C.NaNO3溶液 D.少量CuSO4溶液
你认为不可行的是A、C、D.
4.高温下,炽热的铁与水蒸气在一个密闭的容器中进行反应:3Fe(s)+4H2O(g)?Fe3O4(s)+4H2(g),下列条件的改变对其反应速率几乎无影响的是( )
| A. | 把铁块换成铁粉 | |
| B. | 将容器的体积压缩至原体积的一半 | |
| C. | 若保持压强不变,充入氮气使容器的体积增大 | |
| D. | 若保持体积不变,充入氮气使容器内的压强增大 |