题目内容
18.下列试验能达到预期目的是( )| 实验内容 | 实验目的 | |
| A | 向某未知溶液中加入BaCl2溶液后,再加入稀硝酸观察沉淀的生成 | 检验是否含SO42-离子 |
| B | 向某未知溶液中加入NaOH固体,加热,在管口用湿润的蓝色石蕊试纸检验 | 检验是否含NH4+离子 |
| C | 加热分别用SO2和HClO漂白后的品红溶液 | 探究SO2和HClO漂白原理的不同 |
| D | 加热盛有浓硫酸和铜的试管 | 探究浓硫酸的脱水性 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.能和氯化钡反应且生成不溶于稀硝酸的离子还有银离子等,且硝酸具有强氧化性;
B.应用红色石蕊试纸;
C.次氯酸的漂白性具有永久性、二氧化硫的漂白性具有暂时性;
D.用浓硫酸和蔗糖探究浓硫酸的脱水性.
解答 解:A.能和氯化钡反应且生成不溶于稀硝酸的离子还有银离子等,且硝酸具有强氧化性,向某未知溶液中加入BaCl2溶液后,再加入稀硝酸观察沉淀的生成,生成的沉淀可能是硫酸钡或氯化银,且硝酸能将亚硫酸根离子或亚硫酸氢根离子氧化生成硫酸根离子,所以不能据此判断含有硫酸根离子,故A错误;
B.氨水溶液呈碱性,可使红色石蕊试纸变蓝,应用红色石蕊试纸,故B错误;
C.次氯酸的漂白性具有永久性、二氧化硫的漂白性具有暂时性,所以可以用加热分别用SO2和HClO漂白后的品红溶液的方法探究SO2和HClO漂白原理的不同,故C正确;
D.用浓硫酸和蔗糖探究浓硫酸的脱水性,浓硫酸和铜的反应体现浓硫酸的强氧化性和酸性,故D错误;
故选C.
点评 本题考查化学实验方案评价,为高频考点,涉及物质性质及其检验、离子检验等知识点,侧重考查学生分析判断及探究能力,明确物质性质是解本题关键,易错选项是B.

练习册系列答案
相关题目
9.下列物质中,不能使溴的四氯化碳溶液和高锰酸钾酸性溶液褪色的是( )
| A. | C5H12 | B. | 丙烯 | C. | C2H4 | D. | 乙炔 |
6.下列各组离子在溶液中能大量共存且溶液为无色透明的是( )
| A. | Ag+、NH4+、OH-、Cl- | B. | Na+、Cu2+、SO42-、NO3- | ||
| C. | K+、Na+、SO42-、Cl- | D. | Ba2+、CO32-、NO3-、K+ |
13.下列有关硫酸和硝酸的叙述正确的是( )
| A. | 在加热条件下,浓硫酸和浓硝酸均能与木炭反应 | |
| B. | 将浓硫酸和浓硝酸分别长期露置于空气中,浓度均会升高 | |
| C. | 稀硫酸和稀硝酸分别与金属反应时,S和N元素的化合价都会发生变化 | |
| D. | 因为浓硫酸和浓硝酸都能与铝反应,所以常温下二者都不能用铝制容器盛放 |
3.下列实验方法或结论叙述正确的是( )
| A. | 用分液漏斗分离水和乙醇的混合物 | |
| B. | 可用湿润的淀粉碘化钾试纸检验氯气 | |
| C. | 用氢氧化钠溶液除去二氧化碳气体中的氯化氢 | |
| D. | 某溶液焰色反应的火焰呈黄色,说明该溶液中只含有钠离子不含钾离子 |
7. 以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高、无污染的特点,其工作原理如图所示.下列说法正确的是( )
以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高、无污染的特点,其工作原理如图所示.下列说法正确的是( )
 以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高、无污染的特点,其工作原理如图所示.下列说法正确的是( )
以氨作为燃料的固体氧化物(含有O2-)燃料电池,具有全固态结构、能量效率高、无污染的特点,其工作原理如图所示.下列说法正确的是( )| A. | 该电池工作时的总反应式为4NH3+5O2═4NO+6H2O | |
| B. | 电池工作时,接触面上的电极反应式为2NH3+3O2--6e-═N2+3H2O | |
| C. | 固体氧化物作为电池工作时的电解质,其作用是让电子在电池内部移动 | |
| D. | 外电路的电流方向为从电极a流向电极b |
8.下列叙述中,正确的是( )
| A. | 金属钠着火时,可以用二氧化碳灭火 | |
| B. | 可将金属钠存放在煤油或四氯化碳中 | |
| C. | 金属钠投入到CuSO4 溶液中,不能置换出单质铜 | |
| D. | 钠在氧气中燃烧观察到的现象是:金属钠熔化,火焰黄色,生成白色固体 |
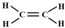
 在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0反应中NH3的物质的量浓度的变化的情况如图:
在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0反应中NH3的物质的量浓度的变化的情况如图: