题目内容
8.下列叙述中,正确的是( )| A. | 金属钠着火时,可以用二氧化碳灭火 | |
| B. | 可将金属钠存放在煤油或四氯化碳中 | |
| C. | 金属钠投入到CuSO4 溶液中,不能置换出单质铜 | |
| D. | 钠在氧气中燃烧观察到的现象是:金属钠熔化,火焰黄色,生成白色固体 |
分析 A、Na的性质活泼,加热时反应生成过氧化钠,过氧化钠能二氧化碳反应;
B、钠的密度比四氯化碳小,所以不能用其存放;
C、钠投入硫酸铜溶液,先与水反应生成氢氧化钠和氢气,氢氧化钠与硫酸铜反应生成氢氧化铜沉淀和硫酸钠;
D、生成过氧化钠淡黄色的固体.
解答 解:A、Na的性质活泼,加热时反应生成过氧化钠,过氧化钠能二氧化碳反应,所以不能二氧化碳灭火,故A错误;
B、钠的密度比四氯化碳小,所以不能用其存放,故B错误;
C、钠投入硫酸铜溶液,先与水反应生成氢氧化钠和氢气,氢氧化钠与硫酸铜反应生成氢氧化铜沉淀和硫酸钠,得不到铜,故C正确;
D、生成过氧化钠淡黄色的固体,所以不是白色的固体,故D错误;
故选C.
点评 本题考查了钠的化学性质,特别钠与硫酸铜溶液的反应,明确钠的化学性质是解题关键,注意钠与盐溶液反应的过程,题目难度不大.

练习册系列答案
 期末宝典单元检测分类复习卷系列答案
期末宝典单元检测分类复习卷系列答案
相关题目
18.下列试验能达到预期目的是( )
| 实验内容 | 实验目的 | |
| A | 向某未知溶液中加入BaCl2溶液后,再加入稀硝酸观察沉淀的生成 | 检验是否含SO42-离子 |
| B | 向某未知溶液中加入NaOH固体,加热,在管口用湿润的蓝色石蕊试纸检验 | 检验是否含NH4+离子 |
| C | 加热分别用SO2和HClO漂白后的品红溶液 | 探究SO2和HClO漂白原理的不同 |
| D | 加热盛有浓硫酸和铜的试管 | 探究浓硫酸的脱水性 |
| A. | A | B. | B | C. | C | D. | D |
19.常温下,下列溶液的离子浓度关系式正确的是( )
| A. | pH=4的氯化铵溶液中,c(H+)=c(NH3.H2O)=1×10-4mol•L-1 | |
| B. | CH3COONa溶液中:c(Na+)>c(CH3COO-) | |
| C. | pH=2的HF溶液与pH=12的NaOH溶液体积比1:1混合:c(Na+)=c(F-)>c(H+)=c(OH-1) | |
| D. | pH相同的①NaOH ②NaClO两种溶液中水的电离程度:①=② |
16.下列有关物质的性质与应用相对的是( )
| A. | PbO2具有氧化性和导电性,故可作为铅蓄电池的负极材料 | |
| B. | 炭具有还原性,一定条件下能 将二氧化硅还原为硅 | |
| C. | 酒精能使蛋白质溶液沉淀析出,可以用来分离提纯蛋白质溶液 | |
| D. | Al的金属较强,可用作飞机火箭的结构材料 |
3.如图为铜-锌-稀硫酸原电池示意图,下列表述正确的是( )
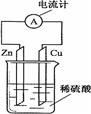

| A. | 电子由铜片通过导线流向锌片 | B. | 正极上的反应为Zn-2e-═Zn2+ | ||
| C. | 反应一段时间后,溶液的pH变小 | D. | 原电池的反应本质是氧化还原反应 |
20.下列各组离子在溶液中能大量共存且溶液为无色透明的是( )
| A. | Ca2+、CO32-、NO3-、K+ | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、NH4+、SO42-、Cl- | D. | Ag+、Al3+、OH-、Cl- |
17.下列有关物质的应用说法正确的是( )
| A. | 生石灰用作食品抗氧化剂 | |
| B. | FeCl3溶液能被铜置换,可用于铜质印刷线路板制作 | |
| C. | 铁红常用作红色油漆和涂料 | |
| D. | 氢氧化钡可作胃酸的中和剂 |

