题目内容
3.标况下,某气态烃2.24L,充分燃烧后生成的二氧化碳和水蒸气的物质的量之比为1:1,将燃烧产物通过浓硫酸,浓硫酸的质量增加3.6g.请回答:(1)此气态烃的结构简式为CH2=CH2,结构式为
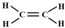
(2)将该气态烃通入盛有Br2的CCl4溶液,发生的反应化学方程式为CH2=CH2+Br2→CH2Br-CH2Br,反应类型为加成反应.
分析 (1)根据n=$\frac{V}{{V}_{m}}$计算出该气态烃的物质的量,根据n=$\frac{m}{M}$计算出该有机物生成水的物质的量,然后结合“二氧化碳和水蒸气的物质的量之比为1:1”及质量守恒定律确定其分子式、结构简式及结构式;
(2)乙烯与溴发生加成反应生成1,2二溴乙烷,该反应为加成反应.
解答 解:(1)标况下2.24L该气态烃的物质的量为:$\frac{2.24L}{22.4L/mol}$=0.1mol,浓硫酸增重的质量为水的质量,则0.1mol该有机物完全燃烧生成水的物质的量为:$\frac{3.6g}{18g/mol}$=0.2mol,该有机物充分燃烧后生成的二氧化碳和水蒸气的物质的量之比为1:1,则生成二氧化碳的物质的量也是0.2mol,
根据质量守恒定律,该有机物分子中含有C、H原子数为:N(C)=$\frac{0.2mol}{0.1mol}$=2、N(H)=$\frac{0.2mol×2}{0.1mol}$=4,则该有机物的分子式为:C2H4,所以该有机物为乙烯,其结构简式为:CH2=CH2,结构式为: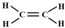 ,
,
故答案为:CH2=CH2;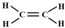 ;
;
(2)乙烯分子中含有碳碳双键,能够与溴单质发生加成反应,反应的化学方程式为:CH2=CH2+Br2→CH2Br-CH2Br,
故答案为:CH2=CH2+Br2→CH2Br-CH2Br; 加成反应.
点评 本题考查了有机物分子式、结构简式的确定,题目难度中等,熟练掌握常见有机物结构与性质为解答关键,注意掌握质量守恒定律在确定有机物分子式中的应用方法.

练习册系列答案
相关题目
14.X、Y、M、Z四种短周期主族元素的原子半径依次减小,X、Y、Z的电子层数之和为5,X元素原子的最外层电子数是它的电子层数的2倍,Y元素原子的最外层电子数是X和Z两元素原子最外层电子数的总和,M是地壳中含量最多的元素.下列说法不正确的是( )
| A. | 化合物YZ3极易溶解于水 | |
| B. | Z与M可以形成共价化合物 | |
| C. | 12g14X中含有质子的物质的量为6mol | |
| D. | 由上述四种元素组成的离子化合物受热易分解 |
11.下列化合物分子中,在核磁共振氢谱图中能给出三种信号的是( )
| A. | CH3CH2CH3 | B. | CH3COCH2CH3 | C. | CH3CH2CH2OH | D. | CH3OCH3 |
8.某温度时,测得纯水中c(H+)=2×10-7 mol/L,则此时c(OH-)为( )
| A. | 0.5×10-7 mol/L | B. | 1×10-7 mol/L | C. | 2×10-7 mol/L | D. | 4×10-7 mol/L |
15.能说明醋酸是弱电解质的事实是( )
| A. | 醋酸溶液的导电性比盐酸弱 | |
| B. | 0.1mol/LCH3COOH溶液中,氢离子浓度约为0.001mol/L | |
| C. | 醋酸溶液用水稀释后,氢离子浓度下降 | |
| D. | 醋酸溶液与碳酸钙反应,缓慢放出二氧化碳 |
18.下列试验能达到预期目的是( )
| 实验内容 | 实验目的 | |
| A | 向某未知溶液中加入BaCl2溶液后,再加入稀硝酸观察沉淀的生成 | 检验是否含SO42-离子 |
| B | 向某未知溶液中加入NaOH固体,加热,在管口用湿润的蓝色石蕊试纸检验 | 检验是否含NH4+离子 |
| C | 加热分别用SO2和HClO漂白后的品红溶液 | 探究SO2和HClO漂白原理的不同 |
| D | 加热盛有浓硫酸和铜的试管 | 探究浓硫酸的脱水性 |
| A. | A | B. | B | C. | C | D. | D |
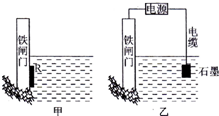 钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$.
钢铁很容易生锈而被腐蚀,每年因腐蚀而损失的钢材占世界钢铁年产量的$\frac{1}{4}$.