题目内容
10. 在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0反应中NH3的物质的量浓度的变化的情况如图:
在一容积为2L的密闭容器内加入0.2mol的N2和0.6mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0反应中NH3的物质的量浓度的变化的情况如图:(1)根据如图,计算从反应开始到4min时,平均反应速率v(H2)为0.0375mol/(L•min);N2转化率为50%.
(2)不能说明该反应已达到平衡状态的是AD
A.V正(N2)=V逆(NH3)
B.容器内压强保持不变
C.气体的平均摩尔质量不变D.气体的密度保持不变
(3)反应达到平衡后,第5分钟末,保持其它条件不变,若改变反应温度,则NH3的物质的量浓度不可能为AC.
A.0.20mol/L B.0.12mol/LC.0.10mol/L D.0.08mol/L
(4)反应达到平衡后,第5分钟末,保持其它条件不变,在恒压条件下充入He气,平衡向逆反应方向移动(填“向逆反应方向”、“向正反应方向”或“不”),化学平衡常数不变(填“增大”、“减小”或“不变”).
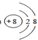
(5)在第5分钟末将容器的体积缩小一半后,若在第8分钟末达到新的平衡(此时NH3的浓度约为0.25mol/L).请在图中画出第5分钟末到此平衡时NH3浓度的变化曲线.
分析 (1)图象分析计算氨气的反应速率=$\frac{△c}{△t}$,速率之比等于化学方程式计量数之比,根据v(H2)=$\frac{3}{2}$c(NH3)进行计算,转化率=$\frac{消耗量}{起始量}$×100%;
(2)达到平衡状态时,正逆反应速率相等,各物质的浓度不变,百分含量不变等角度分析;
(3)根据反应的可逆性特点以及温度改变平衡一定发生移动进行判断;
(4)保持其它条件不变,在恒压条件下充入He气,体积不变时相当于增大了容器内气体压强,为保持恒压容器体积会增大,压强减小平衡想气体体积增大的方向进行,平衡常数只随温度变化;
(5)第5分钟末将容器的体积缩小一半后,氨气的浓度为原来的一倍,压强增大平衡向正方向移动,氨气的浓度逐渐增大,到8min时达到平衡,浓度约为0.25mol/L,以此解答.
解答 解:(1)根据图象分析平衡时氨气的浓度为0.1mol/L,时间为4min,所以依据速率之比等于系数之比得到:v(H2)=$\frac{3}{2}$v(NH3)=$\frac{3}{2}$×$\frac{0.1mol/L}{4min}$=0.0375 mol/(L•min),平衡时生成氨气物质的量=0.1mol/L×2L=0.2mol,消耗氮气物质的量=0.1mol,N2转化率=$\frac{0.1mol}{0.2mol}$×100%=50%
故答案为:0.0375 mol/(L•min),50%;
(2)A.NH3的生成速率与N2的生成速率为1:2时可说明达到平衡状态,故A符合;
B.反应前后的气体的计量数之和不相等,容器中气体的压强不变说明达到平衡状态,能作为判断的依据,故B不符合;
C、反应前后气体质量不变,气体物质的量改变,当气体的平均摩尔质量不变时什么反应达到平衡状态,故C不符合;
D.容器中混合气体的密度保持不变不能作为判断的依据,因为容器的体积不变,气体的质量不变,无论是否达到平衡状态,气体的密度都不变,故D符合;
故答案为:AD;
(3)该反应为可逆反应,反应物不可能完全转化,则NH3的物质的量浓度不可能为0.2mol/L,温度改变平衡一定发生移动,则NH3的物质的量浓度不可能为0.1mol/L,
故答案为:AC;
(4)反应达到平衡后,第5分钟末,保持其它条件不变,在恒压条件下充入He气,体积不变时相当于增大了容器内气体压强,为保持恒压容器体积会增大,压强减小平衡想气体体积增大的方向进行,平衡逆反应方向进行,平衡常数只随温度变化,改变压强、浓度,平衡常数不变;
故答案为:向逆反应方向,不变;
(5)第5分钟末将容器的体积缩小一半后,氨气的浓度为原来的一倍,压强增大平衡向正方向移动,氨气的浓度逐渐增大,到8min时达到平衡,浓度约为0.25mol/L, ,
,
故答案为: .
.
点评 本题考查化学平衡移动问题,涉及平衡常数、反应速率、平衡标志以及平衡图象等问题,题目难度中等,注意方法性问题的积累.

| A. | 醋酸溶液的导电性比盐酸弱 | |
| B. | 0.1mol/LCH3COOH溶液中,氢离子浓度约为0.001mol/L | |
| C. | 醋酸溶液用水稀释后,氢离子浓度下降 | |
| D. | 醋酸溶液与碳酸钙反应,缓慢放出二氧化碳 |
| A. | Na和Mg | B. | Cl2和Br2 | C. | NaCl和H2O | D. | NaOH和 H2 |
| 实验内容 | 实验目的 | |
| A | 向某未知溶液中加入BaCl2溶液后,再加入稀硝酸观察沉淀的生成 | 检验是否含SO42-离子 |
| B | 向某未知溶液中加入NaOH固体,加热,在管口用湿润的蓝色石蕊试纸检验 | 检验是否含NH4+离子 |
| C | 加热分别用SO2和HClO漂白后的品红溶液 | 探究SO2和HClO漂白原理的不同 |
| D | 加热盛有浓硫酸和铜的试管 | 探究浓硫酸的脱水性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 称取8.0gCuSO4,加入500mL水 | |
| B. | 称取7.68gCuSO4,加入480mL水 | |
| C. | 称取12.5gCuSO4•5H2O,加水配成500mL溶液 | |
| D. | 称取12.0gCuSO4•5H2O,加水配成480mL溶液 |
| A. | pH=4的氯化铵溶液中,c(H+)=c(NH3.H2O)=1×10-4mol•L-1 | |
| B. | CH3COONa溶液中:c(Na+)>c(CH3COO-) | |
| C. | pH=2的HF溶液与pH=12的NaOH溶液体积比1:1混合:c(Na+)=c(F-)>c(H+)=c(OH-1) | |
| D. | pH相同的①NaOH ②NaClO两种溶液中水的电离程度:①=② |
| A. | Ca2+、CO32-、NO3-、K+ | B. | Cu2+、K+、SO42-、NO3- | ||
| C. | Na+、NH4+、SO42-、Cl- | D. | Ag+、Al3+、OH-、Cl- |
 ,
,