题目内容
13.下列有关硫酸和硝酸的叙述正确的是( )| A. | 在加热条件下,浓硫酸和浓硝酸均能与木炭反应 | |
| B. | 将浓硫酸和浓硝酸分别长期露置于空气中,浓度均会升高 | |
| C. | 稀硫酸和稀硝酸分别与金属反应时,S和N元素的化合价都会发生变化 | |
| D. | 因为浓硫酸和浓硝酸都能与铝反应,所以常温下二者都不能用铝制容器盛放 |
分析 A.浓硫酸、浓硝酸具有强的氧化性,加热条件下都能氧化碳;
B.依据浓硫酸具有吸水性,浓硝酸具有挥发性解答;
C.稀硫酸与金属反应,氢离子表现氧化性;
D.浓硫酸和浓硝酸具有强的氧化性,常温下,遇到铝发生钝化.
解答 解:A.浓硫酸、浓硝酸具有强的氧化性,加热条件下都能氧化碳,都能与木炭反应,故A正确;
B.浓硫酸具有吸水性,长期露置于空气中浓度降低,浓硝酸具有挥发性,硝酸挥发长期露置于空气中浓度降低,故B错误;
C.稀硫酸与金属反应,生成硫酸盐和氢气,氢离子表现氧化性,硫元素化合价不变,故C错误;
D.浓硫酸和浓硝酸具有强的氧化性,常温下,遇到铝发生钝化,阻止反应进行,所以可以用铝制容器盛放,故D错误;
故选:A.
点评 本题考查了浓硫酸、浓硝酸的性质,熟悉浓硫酸强氧化性、吸水性,熟悉浓硝酸强氧化性、挥发性即可解答,题目难度不大.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
4. 通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H).
通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H).
(1)按要求完成填空
①2HCl(g)=H2(g)+Cl2(g)△H=+183kJ/mol;
②N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol
则N-H键的键能是391kJ/mol
(2)1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式为:
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234 kJ•mol-1
(3)已知:
2Al(s)+$\frac{3}{2}$O2(g)═Al2O3(s)△H=-1 644.3kJ•mol-1
2Fe(s)+$\frac{3}{2}$O2(g)═Fe2O3(s)△H=-815.88kJ•mol-1
试写出铝粉与氧化铁粉末发生铝热反应的热化学方程2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s)△H=-828.42kJmol-1.
 通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H).
通常人们把拆开1mol 某化学键所吸收的能量看成该化学键的键能.键能的大小可用于估算化学反应的反应热(△H).| 化学键 | Cl-Cl | H-H | H-Cl | N≡N |
| 键能/kJ•mol | 243 | 436 | 431 | 946 |
①2HCl(g)=H2(g)+Cl2(g)△H=+183kJ/mol;
②N2(g)+3H2(g)=2NH3(g)△H=-92kJ/mol
则N-H键的键能是391kJ/mol
(2)1mol NO2和1mol CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式为:
NO2(g)+CO(g)=CO2(g)+NO(g)△H=-234 kJ•mol-1
(3)已知:
2Al(s)+$\frac{3}{2}$O2(g)═Al2O3(s)△H=-1 644.3kJ•mol-1
2Fe(s)+$\frac{3}{2}$O2(g)═Fe2O3(s)△H=-815.88kJ•mol-1
试写出铝粉与氧化铁粉末发生铝热反应的热化学方程2Al(s)+Fe2O3(s)═Al2O3(s)+2Fe(s)△H=-828.42kJmol-1.
1.在开发海水资源的过程中,下列物质仅通过物理变化就能获得的是( )
| A. | Na和Mg | B. | Cl2和Br2 | C. | NaCl和H2O | D. | NaOH和 H2 |
8.下列有关甲烷的叙述不正确的是( )
| A. | 甲烷是最简单的有机物 | |
| B. | 甲烷是天然气的主要成分 | |
| C. | 甲烷能与氯气在光照条件下发生反应 | |
| D. | 甲烷能使溴的四氯化碳溶液和酸性高锰酸钾溶液褪色 |
18.下列试验能达到预期目的是( )
| 实验内容 | 实验目的 | |
| A | 向某未知溶液中加入BaCl2溶液后,再加入稀硝酸观察沉淀的生成 | 检验是否含SO42-离子 |
| B | 向某未知溶液中加入NaOH固体,加热,在管口用湿润的蓝色石蕊试纸检验 | 检验是否含NH4+离子 |
| C | 加热分别用SO2和HClO漂白后的品红溶液 | 探究SO2和HClO漂白原理的不同 |
| D | 加热盛有浓硫酸和铜的试管 | 探究浓硫酸的脱水性 |
| A. | A | B. | B | C. | C | D. | D |
5.实验室需用480mL 0.10mol/L的CuSO4溶液,现选用500mL的容量瓶配制该溶液,下列方法可行的是( )
| A. | 称取8.0gCuSO4,加入500mL水 | |
| B. | 称取7.68gCuSO4,加入480mL水 | |
| C. | 称取12.5gCuSO4•5H2O,加水配成500mL溶液 | |
| D. | 称取12.0gCuSO4•5H2O,加水配成480mL溶液 |
3.如图为铜-锌-稀硫酸原电池示意图,下列表述正确的是( )
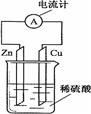

| A. | 电子由铜片通过导线流向锌片 | B. | 正极上的反应为Zn-2e-═Zn2+ | ||
| C. | 反应一段时间后,溶液的pH变小 | D. | 原电池的反应本质是氧化还原反应 |
 ,
,