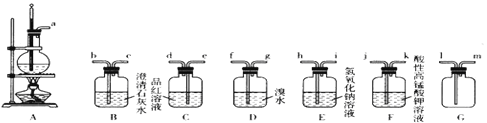
题目内容
【题目】目前海水提溴的最主要方法之一是空气吹出法,工艺流程如下:

以下推断不合理的是
A.流程中循环利用的物质有SO2、Br2、Cl2,等多种
B.SO2吸收溴的反应方程式:SO2+2H2O+Br2=H2SO4+2HBr
C.空气能吹出溴是利用溴易挥发的性质
D.没有采用直接蒸馏含溴海水得到单质溴的主要原因是为了节能
【答案】A
【解析】
A. 流程中SO2转变为H2SO4,Cl2转变为HCl,在流程中没有用到H2SO4和HCl,所以SO2和Cl2都没有循环利用,海水提溴的工业生产的目的是获得Br2,所以Br2也没有循环利用,A推断不合理。
B. 溴有氧化性,可以利用SO2的还原性吸收溴,使之转化为HBr,反应为SO2+2H2O+Br2=H2SO4+2HBr,B推断合理;
C. 溴易挥发,所以可以用热空气吹出,C推断合理;
D. 直接蒸馏含Br2的海水得到单质溴会消耗比较多的能量,没有采用直接蒸馏含Br2的海水得到单质溴主要是为了节能,D推断合理。
答案选A。

【题目】电解质溶液中存在多种平衡。请回答下列问题:
(1)已知:
化学式 | CH3COOH | HClO |
电离常数(25℃) | 1.8×10-5 | 3.0×10-8 |
物质的量浓度均为0.1mol/L的下列溶液:a. CH3COOH b. HClO ,比较二者C(H+)的大小:a______b(填“>”、“<”或“=”)。
(2)常温下,将 0.1mol/L 的 CH3COOH 溶液加水稀释,在稀释过程中,下列表达式的数值变大的 __________(填字母)。
A. c(H+) B.  C. c(H+)·c(OH-)
C. c(H+)·c(OH-)
(3)25℃时,体积均为 10mL,pH 均为 2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至 1000mL,稀释过程中 pH 的变化如图所示。已知:pH= -lgC(H+),则:

①25℃时,醋酸的电离常数________HX的电离常数。(填“>”、“<”或“=”)
②稀释100倍后, 醋酸溶液中由水电离出的 c(H+)________ HX溶液中由水电离出的c(H+)。(填“>”、“<”或“=”)