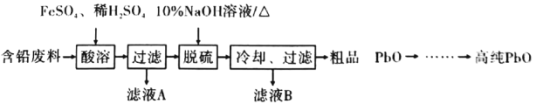
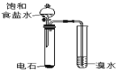
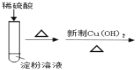
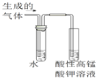
��Ŀ����
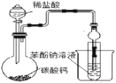
����Ŀ��ʵ���ҿ������Ҵ���Ũ������170��ʱ����ϩ����ѧ��Ӧԭ��ΪCH3CH2OH![]() CH2=CH2��+H2O������Ũ�������ǿ�����ԣ��ʸ÷�Ӧ�ĸ������ж�������Ͷ�����̼�ȡ�ijͬѧ����������Ϣ����Ӧ��ʵ��Ŀ��ѡ������ʵ��װ����ơ�ʵ��(ÿ��װ�ö������ɸ�)��
CH2=CH2��+H2O������Ũ�������ǿ�����ԣ��ʸ÷�Ӧ�ĸ������ж�������Ͷ�����̼�ȡ�ijͬѧ����������Ϣ����Ӧ��ʵ��Ŀ��ѡ������ʵ��װ����ơ�ʵ��(ÿ��װ�ö������ɸ�)��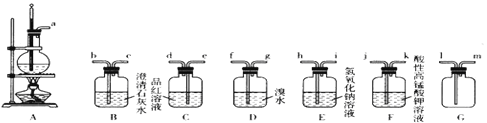
��ش��������⣺
��1����֤�Ҵ���Ũ�����Ϸ�Ӧ�����˶�������Ͷ�����̼��
��ѡ���Ҫװ�ò��������ӣ�a��__________________(��ӿ����)��
��ȷ������������ж�����̼���ڵ�ʵ������_________________________________��
��2��ѡ��װ���Ʊ�1��2���������顣
�ٸ�ͬѧ��Ƶķ�����װ������˳��ΪA��E��D���˷����Ƿ����?_________(���������������)������������������Ľ�������____________________��
�ڷ����1��2����������IJ�����ʹ�õIJ�������Ϊ________________________��
����ͬѧ������A��E֮������Gװ�ã���������_______��a��Gװ�ýӿ�_______(�1����m��)���ӡ�
���𰸡�e��d��f��g��e��d��b �ڶ���Cװ����Ʒ����Һ����ɫ��Bװ���г���ʯ��ˮ����� �������� ��E��D֮������һ��Cװ�ã� ��Һ©�����ձ��� ������(������ȫƿ) m
��������
��1�����Ҵ���Ũ���ᷴӦ��Ũ���������ˮ�ԣ��Ҵ�������̼����̼��Ũ������ȷ�Ӧ�ж�������Ͷ�����̼���ɣ���֤SO2��Ʒ����Һ����ɫ��ȥ˵����������SO2��Ȼ������ˮ��ȥ�����SO2����Ʒ����Һ֤��SO2�Ѿ���ȫ����ȥ�����ó���ʯ��ˮ֤��CO2�Ĵ��ڣ�����װ�õ�����˳��Ϊ��a��e��d��f��g��e��d��b��
�ڵ���һ��Cƿ��Ʒ����Һ����ɫ��Bƿ��Һ����ǣ���֤������������ж�����̼���ڣ�
��2���ٲ���������E��D֮������һ��Cװ�ã��Ʊ�1��2-���������װ��ΪA��E��C��D��
��1��2-�������鲻����ˮ������ͨ����Һ���������1��2-�������飬�õ�����Ҫ����Ϊ��Һ©�����ձ���
�۶�������Ͷ�����̼������������������Һ��Ӧ�����·���������������Gװ�ÿ��Է�ֹ���������˰�ȫƿ�����ã�a��Gװ�ýӿ�m���ӡ�

 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�