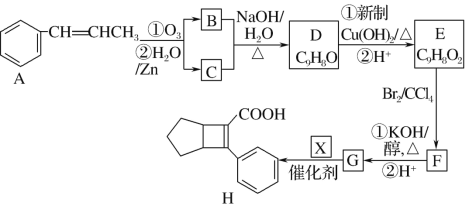
题目内容
【题目】电解质溶液中存在多种平衡。请回答下列问题:
(1)已知:
化学式 | CH3COOH | HClO |
电离常数(25℃) | 1.8×10-5 | 3.0×10-8 |
物质的量浓度均为0.1mol/L的下列溶液:a. CH3COOH b. HClO ,比较二者C(H+)的大小:a______b(填“>”、“<”或“=”)。
(2)常温下,将 0.1mol/L 的 CH3COOH 溶液加水稀释,在稀释过程中,下列表达式的数值变大的 __________(填字母)。
A. c(H+) B.  C. c(H+)·c(OH-)
C. c(H+)·c(OH-)
(3)25℃时,体积均为 10mL,pH 均为 2 的醋酸溶液与一元酸 HX 溶液分别加水稀释至 1000mL,稀释过程中 pH 的变化如图所示。已知:pH= -lgC(H+),则:

①25℃时,醋酸的电离常数________HX的电离常数。(填“>”、“<”或“=”)
②稀释100倍后, 醋酸溶液中由水电离出的 c(H+)________ HX溶液中由水电离出的c(H+)。(填“>”、“<”或“=”)
【答案】> B < <
【解析】
(1)相同浓度下,电离平衡常数越大,酸的电离程度越大,溶液酸性越强;
(2)常温下,将CH3COOH 溶液加水稀释过程中,c(H+)、c(CH3COO-)均减小;
(3)①稀释过程中较弱酸电离程度增大程度大,因此等pH的酸溶液稀释过程中较弱酸的氢离子浓度一直大于较强酸的氢离子浓度;
②根据酸溶液中氢离子浓度越大对水的抑制能力越强,分析判断。
(1)根据题意知,CH3COOH的电离平衡常数比HClO大,故CH3COOH的酸性比HClO的酸性强,则物质的量浓度均为0.1mol/L CH3COOH和HClO溶液中,二者c(H+)的大小关系为:a>b;
故答案为:>;
(2)常温下,将CH3COOH 溶液加水稀释过程中,c(H+)、c(CH3COO-)均减小,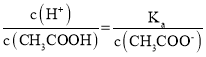 ,则
,则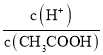 增大;c(H+)·c(OH-)=Kw,温度不变,其值不变;
增大;c(H+)·c(OH-)=Kw,温度不变,其值不变;
故答案为:B;
(3)①稀释过程中较弱酸电离程度增大程度大,因此等pH的酸溶液稀释过程中较弱酸的氢离子浓度一直大于较强酸的氢离子浓度,稀释相同的倍数,HX的pH的变化比CH3COOH的大,故HX酸性强,电离平衡常数大,则25℃时,醋酸的电离常数小于HX的电离常数;
故答案为:<;
②稀释100倍后,醋酸溶液中氢离子浓度大于HX溶液中的氢离子浓度,故对水的抑制能力也比较强,则醋酸溶液中由水电离出的 c(H+)<HX溶液中由水电离出的c(H+);
故答案为:<。

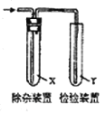
【题目】欲用如图装置对所制备的气体进行除杂、检验,其设计方案合理的是( )
制备气体 | X(除杂试剂) | Y(检验试剂) |
| |
A | 生石灰与浓氨水 | 浓硫酸 | 红色石蕊试纸 | |
B | 电石与NaC1水溶液 | H2O | Br2的CCl4溶液 | |
C | C2H5OH与浓硫酸加热至170℃ | 饱和NaHSO3溶液 | K2Cr2O7酸性溶液 | |
D | CH3CH2Br与NaOH乙醇溶液共热 | H2O | KMnO4酸性溶液 |
A.AB.BC.CD.D
【题目】现有部分元素的原子结构特点如表,下列叙述中正确的是( )
X | L层电子数是K层电子数的3倍 |
Y | 核外电子层数等于原子序数 |
Z | L层电子数是K层和M层电子数之和 |
W | 共用三对电子形成双原子分子,常温下为气体单质 |
A.W原子结构示意图为![]()
B.元素X和Y只能形成原子个数比为1∶2的化合物
C.元素X比元素Z的非金属性强
D.X、Y、Z、W四种元素不能形成离子化合物