题目内容
【题目】在一定条件下,由CO2与H2反应可合成甲醇,反应为CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g);如图所示为向一固定容积为2 L的绝热密闭容器中加入1 mol CH3OH和1 mol H2O后,反应体系内CO2浓度的变化;其中第5 min 时,在其他条件不变的条件下,向容器中加入一定物质的量的 CO2和H2,第8 min 重新达到平衡状态,此时反应体系内c(H2)=c(CH3OH)。下列说法错误的是
CH3OH(g)+H2O(g);如图所示为向一固定容积为2 L的绝热密闭容器中加入1 mol CH3OH和1 mol H2O后,反应体系内CO2浓度的变化;其中第5 min 时,在其他条件不变的条件下,向容器中加入一定物质的量的 CO2和H2,第8 min 重新达到平衡状态,此时反应体系内c(H2)=c(CH3OH)。下列说法错误的是

A. 0~4 min 内,生成CO2的平均反应速率为0.025 mol·L-1·min-1
B. 第5 min 时在反应容器中加入了0.20 mol CO2和0.40 mol H2
C. 8 min后CH3OH的平衡浓度为0.425 mol·L-1
D. 前5 min CH3OH的转化率为20%,5~8 min H2的转化率为37.5%
【答案】D
【解析】
0~4 min 内,c(CO2)由0增加到0.10 mol·L-1,CO2平均反应速率为v(CO2)=0.10 mol·L-1/4 min=0.025 mol·L-1·min-1,A项正确;
当反应进行到第4 min时,反应达到了平衡状态,
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
起始(mol) 0 0 1 1
变化(mol) 0.2 0.6 0.2 0.2
平衡(mol) 0.2 0.6 0.8 0.8
此时c(H2)=0.30 mol·L-1,c(CH3OH)=0.50 mol·L-1-0.10 mol·L-1=0.40 mol·L-1,c(H2O)=0.40 mol·L-1;
从题图可得,5 min 时加入了CO2,c(CO2)由0.10 mol·L-1增大到0.20 mol·L-1,即加入了0.20 mol CO2;
当反应进行到第8 min时,反应重新达到平衡,在5~8 min内消耗CO2 0.05 mol,同时消耗H2 0.15 mol,c(CO2)减小了0.025 mol·L-1,c(H2)减小了0.075 mol·L-1,而c(CH3OH)增大了0.025 mol·L-1,变为0.425 mol·L-1;由于此时c(H2)=c(CH3OH),即c(H2)=0.425 mol·L-1,那么在第5min时c(H2)=0.50 mol·L-1,即加入了0.40 mol H2,即B、C项正确;
根据上述分析前5 min 内CH3OH的转化率=0.2 mol/1 mol×100%=20%,5~8 min 内H2的浓度由0.50 mol·L-1变为0.425 mol·L-1,减少了0.075 mol·L-1,转化率为![]() ×100%=15%,D项错误。
×100%=15%,D项错误。
故答案选D。

 通城学典默写能手系列答案
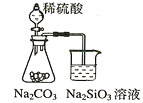
通城学典默写能手系列答案【题目】Ⅰ.K2Cr2O7的水溶液中存在如下平衡:Cr2O72-(aq)+ H2O(l)![]() 2CrO42-(aq)+ 2H+(aq),平衡常数表达式为__;往上述溶液中加入氢氧化钠溶液现象为___;此实验现象,符合勒夏特列原理:如果改变维持化学平衡的条件(浓度、压力和温度),平衡就会向着__这种改变的方向移动。
2CrO42-(aq)+ 2H+(aq),平衡常数表达式为__;往上述溶液中加入氢氧化钠溶液现象为___;此实验现象,符合勒夏特列原理:如果改变维持化学平衡的条件(浓度、压力和温度),平衡就会向着__这种改变的方向移动。
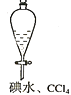
Ⅱ. 为了证明化学反应有一定的限度,利用铁离子可以氧化碘离子的反应进行了如下探究活动:
(1)步骤1:取8mL0.1molL﹣1的KI溶液于试管,滴加0.1molL﹣1的FeCl3溶液5~6滴,振荡;
步骤2:在上述试管中加入2mLCCl4,充分振荡、静置;
步骤3:取上述步骤2静置分层后的上层水溶液少量于试管,滴加5~6滴0.1molL﹣1___(试剂名称),振荡,未见溶液呈血红色。
(2)探究的目的是通过检验Fe3+,来验证是否有Fe3+残留,从而证明化学反应有一定的限度。针对实验现象,同学们提出了下列两种猜想:
猜想一:________________
猜想二:Fe3+大部分转化为Fe2+,使生成Fe(SCN)3浓度极小,肉眼无法观察其颜色
为了验证猜想,在查阅资料后,获得下列信息:
信息一:Fe3+可与[Fe(CN)6]4﹣反应生成蓝色沉淀,反应的离子方程式为___,用K4[Fe(CN)6]溶液检验Fe3+的灵敏度比用KSCN更高。
信息二:乙醚比水轻且微溶于水,Fe(SCN)3在乙醚中的溶解度比在水中大。
结合新信息,请你完成以下实验:各取少许步骤3的水溶液分别于试管A、B中,请将相关的实验操作、预期现象和结论填入下表空白处:
实验操作 | 预期现象 | 结论 |
实验1:①___________ | ②______ | 则“猜想一”不成立 |
实验2:在试管B加入少量乙醚,充分振荡,静置 | ③______ | 则“猜想二”成立 |