题目内容
【题目】下列解释事实的离子方程式正确的是( )
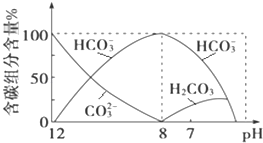
A.强酸性环境中K+、Na+、 Cl- 、HCO3- 不能大量共存:HCO3-+H+=CO2 +H2O
B.碳酸钠溶液显碱性:CO32-+2H2O ![]() H2CO3 +2OH-
H2CO3 +2OH-
C.往澄清石灰水中通入过量二氧化碳:Ca2++2OH-+CO2=CaCO3↓+H2O
D.将少量二氧化硫通入次氯酸钠溶液中:SO2+H2O+ClO-═SO42-+Cl-+2H+
【答案】A
【解析】
A. 强酸性环境中K+、Na+、Cl-、HCO3-不能大量共存,主要是HCO3-与H+会发生反应,生成CO2和H2O,A正确;
B. 碳酸钠水解使溶液显碱性,离子反应为CO32-+H2O ![]() HCO3-+OH-,B错误;
HCO3-+OH-,B错误;
C. 往澄清石灰水中通入过量二氧化碳,离子反应为OH-+CO2=HCO3-,C错误;
D. 将少量二氧化硫通入次氯酸钠溶液中,离子反应为SO2+H2O+3ClO-═SO42-+Cl-+2HClO,D错误。
故选A。

练习册系列答案
相关题目
【题目】测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
A. Na2SO3溶液中存在水解平衡:![]() +H2O
+H2O![]()
![]() +OH
+OH
B. ④的pH与①不同,是由于![]() 浓度减小造成的
浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的Kw值相等